摘要
EEG微状态代表静息EEG记录中观察到的功能脑网络,在快速切换到另一个网络之前保持稳定40-120ms。假设微观状态特征(即持续时间、发生率、覆盖百分比和过渡)可以作为精神和神经障碍以及社会心理特征的神经标记。然而,需要关于其重测可靠性的可靠数据来为这一假设提供基础。此外,研究人员目前使用不同的方法方法,需要比较它们的一致性和适用性,以产生可靠的结果。基于一个广泛的数据集,主要代表西方社会(2天,每次两次静息脑电图测量;第一天:n = 583;第2天:n = 542),我们发现微观状态持续时间、发生率和覆盖率的短期重测信度良好至极好(平均ICCs = 0.874-0.920)。即使测量间隔超过半年,这些微状态特征的总体长期重测信度也很好(平均ICCs = 0.671-0.852),这支持了长期以来的观点,即微状态的持续时间、发生率和覆盖率代表了稳定的神经特征。研究结果在不同的EEG系统(64 vs 30电极)、记录长度(3 vs 2分钟)和认知状态(实验前vs后)中都是稳健的。然而,我们发现转换的重测可靠性很差。在聚类过程中,微状态特征具有良好到极好的一致性(过渡除外),并且两种过程都产生可靠的结果。与个体拟合相比,均值拟合的结果更可靠。总的来说,这些发现为微态方法的可靠性提供了有力的证据。
类似的内容被其他人浏览
介绍
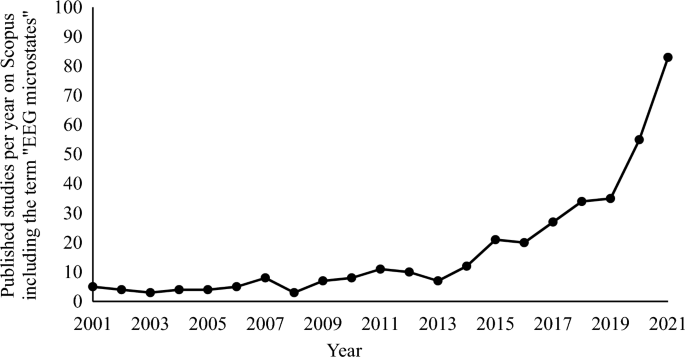
微态分析是一种常用的方法,用于研究毫秒级大规模脑网络的时间动态,使用多通道脑电图(EEG;有关审查,请参阅Michel和Koenig 2018)。在快速过渡到其他网络类型之前,微状态网络显示出大约40-120毫秒的时间稳定性,并且可以在静息EEG记录中可靠地识别。通常,少量的微状态类型(通常是4到7种)解释了EEG中的大部分差异(> 70%;例如,Koenig et al. 2002)。通常分析的微状态特征包括平均持续时间、平均出现次数、每种微状态类型的覆盖率百分比,以及微状态类型之间的转换概率(详细信息,请参见方法)。尽管Lehmann(1971)在50多年前就已经描述了脑电图中短期稳定的脑地形图现象,但对这一研究领域的兴趣最近才显著增加。例如,每年在标题、摘要或关键词中包含“EEG微状态”一词的新发表的研究数量仅在两年内(即2019-2021;见图1)。
该图显示了2001年至2021年间,在在线科学搜索平台Scopus上,以“EEG微状态”为标题、摘要或关键词的每年新发表的研究数量。请注意,多年来,特别是从2019年起,这一数字大幅增加(2019年:35,2020年:55,2021年:83)。
微观状态方法的突然成功有几个原因。最近的出版物表明,微观状态研究的潜力有助于临床心理学和精神病学中更复杂的精神障碍诊断、监测、预后和预防。微观状态特征可以作为精神分裂症的生物标志物(da Cruz et al. 2020;de Bock et al. 2020),情感性障碍(al Zoubi et al. 2019;damborsk
神经科学的另一个问题是人类特征在大脑中的表现是如何稳定的(关于回顾,见DeYoung 2010)。研究表明,微观状态特征与五大人格特征(Zanesco et al. 2020)、智力(Zappasodi et al. 2019;Liu et al. 2020)、自我控制(Kleinert et al. 2022)、攻击性(Kleinert and Nash 2022)、宗教信仰(Nash et al. 2022a)和亲社会态度(Schiller et al. 2020)。此外,微观状态特征似乎是可遗传的,因为它们在兄弟姐妹中被发现是相似的(da Cruz et al. 2020),进一步支持了它们可能与个体间差异有关的观点。因此,微观状态分析已成为研究人类大脑特征相关功能的一种有前途的工具。微状态研究的另一个进步是越来越多的免费工具可以进行微状态分析,包括EEGLAB的微状态工具箱(Koenig 2017)、CARTOOL (Brunet et al. 2011)、RAGU (Koenig et al. 2011)或Python库Pycrostates (f
尽管微观状态方法取得了广泛的成功,但从理论和方法的角度来看,有两个重要的缺点限制了它的有效性。首先,临床和基础研究都建立在理论假设的基础上,即个体随着时间的推移表现出相似的微观状态特征,即微观状态代表神经特征。迄今为止,有三项研究显示微观状态特征的重测信度中等至优异(Khanna et al. 2014;Liu et al. 2020;Antonova et al. 2022)。然而,这些研究的特点是年轻参与者的样本相对较小且不具代表性,并且仅在短间隔内证明了重测信度(Antonova et al. 2022: n = 20,年龄:M = 31.5岁,SD = 12.5,间隔:< 1小时;Khanna et al. 2014: n = 10,年龄:M = 30岁,SD = 10,间隔≥48小时;Liu等。2020:n = 53,年龄:M = 23, SD = 2.4,间隔:1天)。在本文的修改阶段,另一项关于微观状态特征重测信度的研究发表了(Popov et al. 2023),结果显示95名年轻人和93名老年人(间隔7-9天)的重测信度大多较差,这对之前的结果提出了质疑。因此,需要关于微状态特征在数周和数月内的长期重测可靠性的可靠数据来证实微状态特征代表稳定的神经特征的理论。其次,微观状态分析通常在不同的研究和实验室中应用,限制了结果的可比性。更具体地说,使用不同的聚类和拟合程序(详细信息请参见方法)来获得微观状态特征,并且几乎没有证据表明这些方法产生一致的结果。
在目前的研究中,我们的目标是使用多特蒙德生命研究(DVS)收集的大型数据集来缩小这些研究差距;Gajewski et al. 2022)。在分布式交换机中,数据收集于两天(第一天[n = 583]和第二天[n = 542]);平均间隔63天),每天进行两次静息脑电图测量(即每次实验开始时进行预测,每次实验结束后进行后测;第一天平均间隔138分钟,第二天平均间隔99分钟)。这些数据使我们能够在一个主要代表西方社会的样本中评估微观状态特征的短期和长期重测可靠性(详细信息,参见Gajewski et al. 2022)。基于先前对较小样本的研究(Khanna et al. 2014;Liu et al. 2020;Antonova et al. 2022),我们得出了五个假设:首先,我们期望找到微观状态持续时间、发生率和覆盖率至少中等的短期重测信度。尽管Popov及其同事(2023)发现这些特征的重测可靠性较差,但他们使用了不同的软件进行微观状态分析,导致与我们自己的研究的可比性降低。第二,基于两项对过渡进行分析的研究(Liu et al. 2020;Antonova et al. 2022),我们期望找到较低但仍可接受的转换重测信度。第三,我们期望微观状态持续时间、发生次数、覆盖范围和转换至少有适度的长期重测信度,尽管它可能低于短期重测信度。基于第1天和第2天之间的相当大的可变性,我们还将分别分析五组测量间隔不同(即1周,1个月,1至3个月,3至6个月和6个月以上)的微观状态特征的长期重测信度。Khanna及其同事(2014)系统地比较了不同聚类程序(k-means/AAHC)和拟合程序(大均值拟合/个体拟合)获得的微观状态特征的重测信度。第四,基于他们的研究结果,我们期望发现从k均值聚类和AAHC获得的微观状态特征的重测信度同样良好,但与个体拟合相比,从大均值拟合获得的微观状态特征的重测信度更高(有关这些不同方法的详细信息,请参阅方法)。与此相关,我们将分析不同方法中微观状态特征的一致性。我们将通过测试从k-means聚类和AAHC中获得的微观状态特征的关联来研究聚类过程的一致性。以类似的方式,我们将通过检验从大均值拟合和个体拟合中获得的微观状态特征的关联来研究拟合程序的一致性。第五,根据Khanna及其同事(2014)的研究,我们期望聚类过程具有高一致性,但拟合过程只有中等一致性(由于与大均值拟合相比,个体拟合的可靠性较低,特别是在微观状态覆盖率方面)。
材料与方法
数据与样本
本研究的数据是在多特蒙德生命研究(DVS)的背景下收集的,这是一项跨学科、横断面和纵向研究,由德国多特蒙德的莱布尼茨工作环境和人为因素研究中心(IfADo)的人体工程学、心理学和神经科学、免疫学和毒理学部门进行(有关该研究的详细描述,请参见Gajewski等人。2022)。该研究的数据集在年龄、遗传、认知能力和就业方面主要代表了德国工作人口(20-70岁)(Gajewski et al. 2022)。与人口相比,女性在分布式交换机中的比例更高(61.5%比49.6%),拥有大学学位的参与者更多(41.6%比18.5%)。本研究得到了莱布尼茨工作环境与人为因素研究中心当地伦理委员会的批准,并根据赫尔辛基宣言所表达的原则获得了参与者的知情书面同意。本研究的数据和代码可以在OSF存储库(https://osf.io/hy8v7/)中免费获得。
DVS的排除标准为神经、心血管和肿瘤疾病、精神障碍(精神分裂症、严重抑郁症、焦虑症)、头部损伤、严重眼病、限制体能和活动的事故、使用精神活性药物和药物、矫正后视力和听力受限。在这项研究中,609名参与者在第一天完成了第一次实验。对于仅包括第一天测量的所有分析,26名参与者因测量过程中的问题或脑电图质量差而被排除在外(如图所示,超过50%的数据丢失由伪影引起)。结果样本量为n = 583(363名女性,220名男性;年龄:M = 43.83岁,SD = 14.30)。对于所有分析,仅包括从第二天开始的测量,可获得n = 542个样本(334名女性,208名男性;年龄:M = 43.85岁,SD = 14.30)。退出的原因包括实验课程取消、与排除标准相关的个人变化、怀孕以及参与者对Covid - 19大流行的公共限制或担忧。用于分析第一天和第二天微观状态特征长期重测信度的共享样本为n = 525(女性325人,男性200人;年龄:M = 43.87岁,SD = 14.24)。
过程
参与者是通过在线社交媒体、传单、报纸广告、当地印刷和广播媒体以及公共活动期间的公告招募的。此外,该地区的几家公司向员工通报了这项研究。在使用联系表登记DVS后,进行电话访谈,以告知参与者有关研究的信息,检查潜在的排除标准,并评估人口统计数据。在第一次实验之前,参与者在家完成了一系列与本研究无关的问卷调查。
实验由专业的实验室工作人员进行。在第一个实验阶段(第一天),参与者坐在一个电屏蔽的脑电图舱里,在那里他们配备了一个64电极的脑电图系统(Brain Products, Gilching, Germany)。闭眼记录3分钟静息脑电图,睁眼记录3分钟静息脑电图。然后,参与者完成了一系列计算机化的任务,这些任务在其他地方进行评估(详细信息,参见Gajewski et al. 2022)。在实验结束时,记录另一个类似的静息脑电图(测量之间的平均间隔:138分钟)。第二天采用30电极脑电图系统(BioSemi b.v.,阿姆斯特丹,荷兰),程序与第一天相似(除了静息测量记录为2分钟而不是3分钟,并且先进行睁眼测量,然后进行闭眼测量)。按照标准程序(Newson和Thiagarajan 2019),只有闭眼时才用于进一步分析,以避免与视觉线索的主观处理相关的神经激活。第2天第一次和第二次静息脑电图测量的平均间隔为99分钟。仅闭眼时间用于进一步分析。参与者总共获得160欧元的参与奖励(第一天100欧元,第二天60欧元)。
脑电图记录与预处理
每天闭眼静息脑电图记录实验前后。第一天,采用64通道Ag-AgCI有源电极脑电系统(actiCap;Brain Products, Gilching, Germany)。在线采样率为1000 Hz,参比电极放置在FCz位置,接地电极放置在AFz位置。第二天,我们使用30通道EEG系统,带有Ag-AgCI有源电极(BioSemi b.v., Amsterdam, Netherlands),在线采样率为2048 Hz。对于接地和在线参考,使用共模感有源电极和驱动右腿无源电极,共同形成驱动平均电位的反馈回路。使用不同脑电图系统的原因是为了与使用相同脑电图设置的早期研究实现第2天测量的可比性。两套脑电图系统均按扩展的10 - 20系统布置在头皮上,阻抗均在10以下kΩ。
EEG预处理在EEGLAB中进行(Delorme and Makeig 2004)。首先,将数据降采样至500 Hz(第二天为512 Hz),并应用2至20 Hz的带通滤波器(通常用于微状态研究的频率范围;例如,Koenig et al. 2002)。其次,基于谱阈值(EEGLAB函数:pop_rejcont;建议设置;频率范围:15 - 30hz)。第三,将EEG重新导出为平均参考(仅在第一天,因为使用BioSemi EEG系统不需要此步骤)。第四,我们使用prepppipeline来排除有噪声的EEG通道(Bigdely-Shamlo et al. 2015)。第五,我们应用了一个额外的伪影校正方法(EEGLAB函数:pop_autorej;建议设置;检测超大伪影的阈值限制:500µV)。最后,利用独立分量分析(ICA)识别EEG数据中的规则伪像(EEGLAB函数:pop_runica;推荐设置),其次是拒绝概率超过70%的组件,以反映眼球运动或肌肉伪像(EEGLAB功能:ICLabel;Pion-Tonachini et al. 2019)。
脑电微态分析
使用Koenig(2017)的EEGLAB微态工具箱获得微态特征;版本1.2)。首先,从全局电场功率峰值提取电势场图,获得最佳信噪比;其次,将这些个体地图提交到聚类程序中,使用改进的k-means聚类(k-means;Pascual-Marqui et al. 1995;Murray et al. 2008)或原子化和凝聚分层聚类(AAHC;Murray et al. 2008)。在改进的k-means聚类过程中,随机选择预定义数量的k个独立映射作为聚类模板映射。然后,这些模板映射通过重复地将所有单独的映射分配给最相似的模板映射来优化,以适应迭代过程中的数据,然后通过分配的单个映射的第一个主成分更新模板映射,直到达到收敛标准。另一种选择是原子化和凝聚分层聚类过程(AAHC;Murray et al. 2008),该方法首先将所有单个地图作为单独的集群,然后反复分解对全局解释方差贡献最小的集群,将结果未分配的单个地图分配给最相似的集群地图,并通过计算其成员的第一个主成分来更新集群地图。这个过程以迭代的方式重复,直到达到预定数量的地图。我们使用这两种方法来系统地比较它们的一致性,并比较它们的适用性以产生可靠的结果。
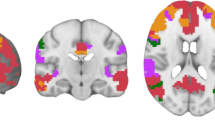
第三,将平均个体图提交给第二次聚类分析,以确定在8种条件下(即第一天/前/k-means,第一天/后/k-means,第二天/前/k-means,第二天/后/k-means,第一天/前/AAHC,第一天/后/AAHC,第二天/前/AAHC,第二天/前/AAHC,第二天/后/AAHC)整个可用样本中最主要的大平均微观状态图。在主体层面上,大平均微观状态图与平均个体图之间存在一一对应关系的约束下。请注意,关于在第二级聚类中应该提取的适当数量的聚类正在进行辩论(例如,Murray等人,2008;Michel and Koenig 2018)。由于当前研究的重点是研究不同测量方法和方法下微观状态特征的可靠性,因此选择聚类数的主要标准是不同条件下大均值微观状态图的一致性。在每种情况下,我们分别提取了4、5、6和7个簇。为了评估不同条件下大均值的一致性,我们计算了每个聚类数的8个大均值上的大均值微观状态图。然后,我们比较了可以用大均值微态解释的平均方差和大均值微态。平均而言,与4个、6个和7个聚类相比,5个聚类的大均值显示出最高的解释方差(97.03% vs 93.16%、89.42%和91.56%),证明了不同条件下几乎完美的一致性(参见表1的大均值微态图,以及表2不同条件下相同类型微态图之间的空间相关性)。此外,所有地图都可以明确地分配到先前确定的微状态类型(例如,Custo等人,2017;Zanesco等人,2020;fsamrat et al. 2022c),而4、6和7组的情况并非如此(见补充材料中的表S2、表S3和表S4)。因此,我们决定仅使用五个微状态图进行所有进一步的分析。
在拟合过程中,基于与大均值微态图的空间相关性,将个体图分配到微态类型。利用最近邻插值法将GFP峰值之间的时间点分配给微状态类型。我们将这一过程称为大均值拟合(GM拟合)。在另一种方法中,基于与大均值微态图的空间相关性,将平均个体图(而不是单个图)分配给微态类型。然后,使用这些平均个体图(而不是均值微状态图)将个体图分配给微状态类型。我们将这一过程称为个体拟合(Ind拟合)。在这两个拟合过程中,根据EEGLAB微状态插件的标准参数(窗口大小为20 ms;不平滑惩罚1;Koenig 2017)。同样,我们使用这两种方法来系统地比较它们的一致性,并比较它们的适用性,以产生可靠的结果。拟合过程产生每个个体的连续微状态图序列。从这些序列中推导出个体的微观状态特征。持续时间是指每一种微状态类型的平均持续时间(毫秒),出现次数是指每一种微状态类型每秒平均出现的次数,覆盖率是指每一种微状态类型所覆盖的脑电图的百分比,过渡次数是指从每一种微状态类型到另一种微状态类型的过渡概率。从一种微状态类型到另一种微状态类型的观察到的转换相对于预期转换的百分比(转换=[每秒观察到的转换-每秒预期的转换]/每秒预期的转换× 100;例如,值10表示从一种微状态类型到另一种微状态类型的转换发生的频率比基于微状态发生的预期频率高10%;参见Schiller et al. 2020)。此外,类型无关的平均微状态特征包括所有微状态类型组合的单个EEG测量中解释方差的百分比,微状态类型的平均持续时间,微状态类型的平均发生次数,以及微状态类型的平均全局场功率(EEG中所有通道从零的平均标准偏差)。
统计分析
作为后续分析的前提,我们通过计算8种不同条件下(即第一天/前/k-means、第一天/后/k-means、第一天/前/k-means、第一天/后/k-means、第一天/前/后/k-means、第一天/前/AAHC、第一天/后/AAHC、第一天/前/AAHC、第一天/后/AAHC)获得的同类型地形微态图之间的空间相关性,检验了5种不同类型(a、B、C、C’、D)地形微态图的一致性。此外,我们分析了微观状态图的短期和长期重测信度,以及它们在聚类过程中的方法一致性(k-means/AAHC)。当将第一天和第二天的地图与不同的电极配置相关联时(见补充材料中的图S1),使用EEGLAB中实现的球面样条插值将64通道数据在空间上重新采样到30通道数据。
在接下来的分析中,我们计算了类内相关系数(ICCs);Gamer et al. 2012),以测试微状态特征的重测可靠性和方法一致性。ICCs小于0.50,在0.50至0.75之间,在0.75至0.90之间,以及大于0.90分别被认为反映了差、中等、良好和极好的信度(Koo and Li 2016)。为了紧凑性和可理解性,我们还计算了微状态持续时间、发生次数和覆盖范围的平均icc,以及跨转换类型的微状态转换的平均icc。为此,我们使用Fisher(1915)的算法对icc进行z变换,取平均值,并将z值反变换为平均相关性。这是必要的,因为相关系数不是正态分布的。然后,我们使用Eid及其同事(2011年)描述的单侧z检验,检验了从不同测量、聚类和拟合程序获得的平均icc之间的显着差异;547 - 548)。简而言之,这个过程对两个相关系数进行z变换,并根据原假设检验它们的差异,同时考虑到不同的样本量。
为了验证我们的假设,我们首先通过计算每个条件(即k-means/GM拟合,k-means/Ind拟合,AAHC/GM拟合,AAHC/Ind拟合)中第一天预测和第一天后测(平均间隔138分钟)获得的微状态特征之间的icc,分析了微状态特征的短期重测信度。从第2天开始(平均间隔99分钟),我们使用前后测量重复这一过程。其次,我们通过计算每个条件下第一天预测和第二天预测获得的微状态特征之间的icc,分析了平均间隔63天内微状态特征的长期重测信度。我们使用第一天和第二天的后期测量重复这一过程。请注意,我们还使用了短期和长期重测信度分析的结果来评估不同聚类程序(k-means/AAHC)和拟合程序(GM拟合/Ind拟合)的适用性,以产生可靠的结果。基于第1天至第2天(1 - 996天)间隔的大变异性,我们还将这些分析分别分为5个不同的组(即第1组:间隔1 - 7天[n = 143],第2组:间隔8-30天[n = 129],第3组:间隔31-90天[n = 142],第4组:间隔91-180天[n = 70],第5组:间隔181天及以上[n = 41])。第三,我们分析了每次测量(第一天/前、第一天/后、第二天/前、第二天/后)中聚类过程中微观状态特征的方法学一致性(k-means/AAHC);两种拟合程序均适用)。第四,我们分析了每次测量(第一天/前、第一天/后、第二天/前、第二天/后)中不同拟合程序(GM拟合/Ind拟合)中微观状态特征的方法学一致性;每个用于两个聚类过程)。注意,另一项研究评估了微观状态特征的年龄和性别差异。
结果
描述性统计
我们计算了16种情况下的脑电图微状态特征(2天[第一天/第二天],两次测量[测量前/测量后],两种聚类程序[kmeans/AAHC]和两种拟合程序[GM拟合/Ind拟合]的所有组合)。在不同的参与者和条件下,脑电图中所有微观状态类型解释的方差的大平均值为81.45%,这与先前的文献(例如,Koenig et al. 2002)非常一致。可用于分析的总时间的大平均值在第一天为141.62秒,在第二天为90.95秒。不同微状态类型、参与者和条件下,微状态的大平均持续时间、平均出现次数和平均全局场强分别为63.25 ms、16.95次/秒和4.81个标准差(各条件下微状态特征描述性统计见补充资料表S1)。
大平均微观状态图
我们计算了每天(第一天/第二天)、测量(测量前/测量后)和聚类过程(k-means/AAHC)的5个聚类的大平均微观状态图集。所有组地图都包括一张从左枕部到右额部的地图,代表微观状态a型(例外:第2天的左枕部到右颞部方向/post/k-means),右枕部到左额部方向的地图,代表微状态B型,枕部到额部方向的地图,代表微状态C型,枕部中央到额部方向的地图,代表微状态C型,枕部到额中央方向的地图,代表微状态D型(表1)。所有大均值微态图都可以明确地分配到从文献中已知的规范微态类型(例如,Koenig等人,2002;Custo et al. 2017;Zanesco等人,2020;fsamrat et al. 2022c)。
短期Retest-Reliability
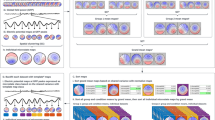
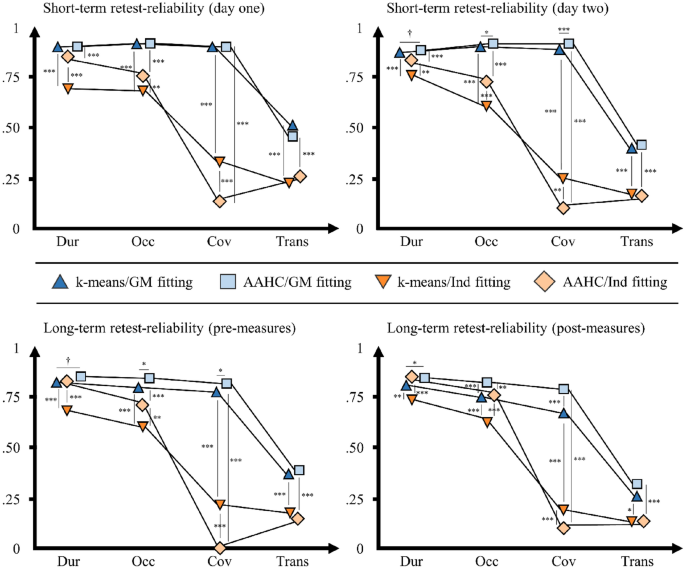
在第一天,计算微观状态特征的短期重测信度,平均间隔为137.69 min (SD = 8.24,范围:112.98-147.27)。所有五种微状态类型的微状态图在两个聚类过程(k-means/AAHC)中都显示出出色的空间重测信度,这表明测量前后的空间相关性很高(见补充材料中的表S5)。关于时间微观状态特征,从k均值聚类和GM拟合中获得的持续时间、发生次数和覆盖范围显示出良好到优异的平均icc(见图2,平均icc见表3,补充材料中的特定类型icc见表S6)。与k均值聚类相比,AAHC产生了高度可比性的结果(所有z检验:p > .260)。然而,在k-means聚类和AAHC中,与GM拟合相比,Ind拟合的平均icc明显较差(差到好)(所有z检验:p < 0.001)。值得注意的是,在所有五种微观状态类型和两种聚类程序中,特定类型的覆盖率icc使用Ind拟合是不可接受的。平均微观状态特征(解释方差、平均持续时间、平均发生率、平均GFP)在所有聚类和拟合过程中显示出良好到优异的平均icc。当使用GM拟合时,微观状态转变在两个聚类过程中显示出相似的(z-检验:p = .138),差到中等的平均icc值;当使用Ind拟合时,在两个聚类过程中显示出相似的(z-检验:p = .306),差甚至更低的平均icc值(两个z-检验:p < .001)。
第2天,在99.10 min的平均间隔内计算短期重测信度(SD = 9.33,范围:55.10-136.47)。确认第一天的结果,微观状态图显示出出色的空间重测可靠性(见补充材料中的表S5)。从k-均值聚类和GM拟合获得的持续时间、发生率和覆盖率显示出良好到优异的平均ICCs(见图2,平均ICCs见表3,补充材料中的特定类型ICCs见表S7)。与k-means聚类相比,使用AAHC产生了可比较的、略高的平均icc(持续时间、发生率和覆盖率的z检验:p =)。090, p =。023, p =。而在k-means聚类和AAHC中,Ind拟合而不是GM拟合导致明显较差(差到好)的平均icc(所有z检验:p < 0.001)。平均微观状态特征在所有聚类和拟合过程中表现出良好的重测信度。当使用GM拟合时,两种聚类程序的微观状态转变显示出相似的(z-检验:p = .325),差到中等的重测信度;当使用Ind拟合时,两种聚类程序的微观状态转变显示出相似的(z-检验:p = .406),差甚至更低的平均icc(两个z-检验:p < .001)。
微观状态特征的平均短期和长期重测信度***p <。001, **p <。010, *p <。050,†p < .10。y轴:类内相关系数(ICC)从0到1的尺度。x轴:微观状态特征(持续时间,Occ发生,覆盖范围,转换)。图例:k-means = k-means聚类,AAHC雾化和凝聚分层聚类,GM拟合= GM拟合过程,Ind拟合= Ind拟合过程。上图:不同微状态类型(A、B、C、C′、D)的微状态特征的平均icc值,显示了它们在第一天的短期重测信度(左上;N = 583)和第二天(右上;n = 542)。下图:微状态类型(A, B, C, C ', D)的微状态特征的平均icc显示了使用预测量的长期重测信度(左下;N = 525)和事后测量(右下;n = 525)。如z检验所示,星号(和叉号)表示从不同方法获得的平均icc之间存在显著(和边际显著)差异。我们分析了聚类程序(k-means/GM拟合vs AAHC/GM拟合,k-means/Ind拟合vs AAHC/Ind拟合)和拟合程序(k-means/GM拟合vs k-means/Ind拟合,AAHC/GM拟合vs AAHC/Ind拟合)之间的平均icc差异。
长期Retest-Reliability
微观状态特征的长期重测信度计算平均间隔为62.60天(SD = 105.63,范围为1-996天)。所有五种微状态类型的微状态图在两个聚类过程(kmeans/AAHC)中都显示出极好的空间长期重测信度,这可以从第一天和第二天的预测量之间的高空间相关性中看出(见补充材料中的表S5)。关于时间微观状态特征,从k均值聚类和GM拟合获得的持续时间、发生率和覆盖率显示中等至良好的平均icc(见图2,平均icc见表3,补充材料中特定类型icc见表S8)。使用AAHC而不是k-means聚类产生了更高的,但可比较的平均ICCs(持续时间、发生率和覆盖率的z检验:p =)。078, p =。017, p =。012年,分别)。然而,Ind拟合而不是GM拟合导致k-means聚类的平均icc明显较差(差到好)(所有z检验:p < 0.001)和AAHC(除了持续时间;持续时间、发生率和覆盖率的z测试:p =。170, p <。0.001, p <。001年,分别)。同样,在所有五种微州类型和两种聚类程序中,特定类型的覆盖率icc使用Ind拟合是不可接受的。平均微观状态特征(解释方差、平均持续时间、平均发生率、平均GFP)在所有聚类和拟合过程中显示出良好的重测信度。当使用GM拟合时,微观状态转变在两种聚类过程中显示相似(z-检验:p = .373),大多数平均ICCs较差;当使用Ind拟合时,两种聚类过程中显示相似(z-检验:p = .327),甚至更低的平均ICCs(两个z-检验:p < .001)。
使用第一天和第二天的事后测量计算类似的分析。来自预测量的支持结果,微观状态图显示出极好的空间重测可靠性(见补充材料中的表S5)。从k-均值聚类和GM拟合获得的持续时间、发生次数和覆盖范围显示,大多数平均ICCs为中等至良好(见图2,平均ICCs见表3,补充材料中的特定类型ICCs见表S9)。使用AAHC而不是k-means聚类产生了更高的平均ICCs(持续时间、发生率和覆盖率的z检验:p =)。028, p <。0.001, p <。而在k-均值聚类(所有z检验:p≤0.001)和AAHC(除了持续时间;持续时间、发生率和覆盖率的z检验:p =。8, p =。0.001, p <。001年,分别)。平均微观状态特征在所有聚类和拟合过程中表现出良好的重测信度。再一次,微观状态转变在使用GM拟合的两个聚类过程中显示出相似的(z-test: p = .111),大多数重测信度较差,并且在使用Ind拟合的两个聚类过程中显示出相似的(z-test: p = .500),甚至更低的重测信度(k-means和AAHC的z-test: p =)。019和p < 0.001)。
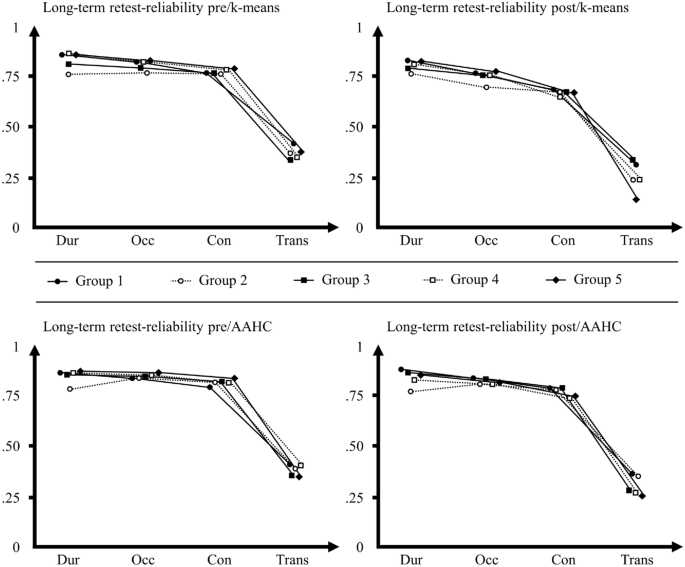
由于第一天和第二天(1-996天)之间的间隔有相当大的可变性,我们将参与者分配到五组中的一组(第1组:间隔1- 7天,第2组:间隔8-30天,第3组:间隔31-90天,第4组:间隔91-180天,第5组:间隔181天及以上)。然后,我们分别分析了每组中微观状态特征的长期重测信度(表3为平均ICCs,表S10、表S11、表S12、表S13和表S14为补充资料中每组特定类型ICCs)。由于与GM拟合相比,Ind拟合获得的微观状态特征的重测信度明显较低,因此我们在这些分析中只使用GM拟合。除了少数例外情况(300例icc中有6例可靠性较差),在所有条件下(pre/k-means, post/k-means, pre/AAHC, post/AAHC),持续时间、发生率和覆盖范围的icc均为中等(300例icc中有72例)、良好(300例icc中有210例)或优秀(320例icc中有12例),即使在第一天和第二天之间间隔超过6个月的参与者中也是如此。与整个样本一样,在不同的组和条件下,转换的重测信度从差(400个icc中有329个)到中等(400个icc中有71个)。值得注意的是,长期重测信度没有随着第一天和第二天间隔的增加而系统性下降(见图3;平均icc组间差异见补充材料表S15)。
测量间隔不同的组中微观状态特征的平均长期重测信度n = 525。y轴:类内相关系数(ICC)从0到1的尺度。x轴:微观状态特征(持续时间,Occ发生,覆盖范围,转换)。pre = pre-measures, post = post-measures, k-means = k-means聚类,AAHC原子化和聚集分层聚类;图例:组1 =间隔1 - 7天,组2:间隔8-30天,组3:间隔31-90天,组4:间隔91-180天,组5:间隔181天及以上。上图:每组不同类型的微观状态特征的平均ICCs,显示了它们在测量前和k-means聚类(左上)以及测量后和k-means聚类(右上)的长期重测信度。下图:不同类型微观状态特征的平均icc,显示了测量前和AAHC(左上)、测量后和AAHC(右上)的长期重测信度;关于平均icc之间的组间差异(由z检验显示),见补充材料中的表S15。值得注意的是,在所有四种情况下,随着第一天和第二天间隔的增加,重测信度没有系统性的降低
跨集群过程的一致性
在每次测量中(第一天/前、第一天/后、第二天/前、第二天/后)测试两个聚类过程(k-means/AAHC)中微观状态特征的一致性。所有五种微态类型的微态图在聚类过程中表现出良好的整体一致性,这可以从k-means聚类和AAHC获得的图之间的高空间相关性中看出(见补充材料中的表S5)。如前所述,在AAHC中,与枕部中央到额部的定位相比,k均值聚类导致微观状态C型图的中央到额部定位。因此,在第一天/预测量中,AAHC的C′图与k-means聚类的C′图的相关性强于k-means聚类的C′图(r =)。695 vs r = .834)和第一天/后测量(r =。712 vs r = .818)。此外,第2天/后测量的A图在k-means聚类中显示了从左枕部到右颞部的方向,而在所有其他测量中则显示了从左枕部到右额部的方向,这就是为什么从AAHC获得的该测量的A图与k-means聚类的C图有更强的关联(r =)。699 vs r = .837)。尽管存在这些微小的不一致,但从k-means聚类获得的20幅图中有17幅与从AAHC获得的对应图显示出最强的相关性(所有相关性> 0.903)。
关于时间微观状态特征,从k均值聚类和GM拟合中获得的持续时间、发生率和覆盖率,与不同天数和测量方法的AAHC相比,大多数平均icc都表现优异(参见表3的平均icc和表S16和表S17的补充材料中第一天和第二天特定类型icc)。然而,在所有测量中,与GM拟合相比,Ind拟合导致聚类程序的平均icc明显较差(差到好)(所有z检验:p < 0.001)。在所有五种微观状态类型和两种聚类程序中,覆盖的类型特异性icc使用Ind拟合是不可接受的。无论采用何种拟合程序,平均微观状态特征(解释方差、平均持续时间、平均发生率、平均GFP)在聚类过程中都显示出良好到优异的平均icc。当使用GM拟合时,微观状态转变显示中等至良好的平均icc,而当使用Ind拟合时,一致性较差,显着降低(所有z检验:p < 0.001)。
拟合程序的一致性
k均值聚类后从GM拟合和Ind拟合获得的持续时间、发生率、覆盖范围和转变显示,不同天数和测量的平均ICCs从差到好(平均ICCs见表3,特定类型ICCs见表S18和表S19)。AAHC后的类似分析得出了关于持续时间的可比平均icc(第一天/预测量、第一天/后测量、第二天/前测量和第二天/后测量的z检验:p =。004, p =。036, p =。354, p =。164),但关于发生率、覆盖率和转换的平均icc较差(第一天/预测量的发生率、覆盖率和转换的z检验:p <。001, p <。001, p =。003年,分别;对第一天/测量后的事件、覆盖率和转换进行z测试:p <。001, p <。001, p =。012年,分别;第2天/预测量的发生、覆盖率和过渡的z检验:p <。001, p <。001, p =。191年,分别;对于第二天/测量后的事件、覆盖率和过渡,z检验:p <。001, p <。001, p =。030年,分别)。
讨论
我们的研究结果表明,地形图在4个独立的测量方法(第一天/前、第一天/后、第2天/前、第2天/后)和2个聚类程序(k-means/AAHC)中可以划分为A、B、C、C '和D 5种微观状态类型,具有良好的一致性。相反,提取4、6或7个簇会产生不一致的微状态图组合。这一发现与最近的一项研究一致,该研究发现,提取与我们非常相似的五个集群,在n = 203的大样本中,产生了跨不同EEG频带和行为条件的高度可比的微状态图(fsamrat et al. 2022c)。此外,先前的研究使用了客观的元标准(可在CARTOOL软件中获得;Brunet et al. 2011)经常识别相同的五个集群以最优拟合他们的数据(例如,Pascual-Marqui et al. 1995;damborsk
本研究的主要目的是评估脑电图微状态特征的短期和长期重测信度。正如预测的那样,微状态持续时间、发生率和覆盖范围的短期重测信度在平均138分钟的间隔内具有良好的到优异的信度。这一发现可以用平均间隔99分钟的第2天的两个独立脑电图测量来证实。此外,在平均间隔63天的时间内,大多数情况下具有良好的长期重测信度系数。同样,这一发现可以通过每天测试电池后记录的两个独立脑电图来证实。我们还测试了五组测量间隔不同的微观状态特征的长期重测信度。令人惊讶的是,随着时间间隔的增加,重测信度并没有系统性的下降。事实上,即使在测量之间间隔至少半年的参与者,在微状态持续时间、发生情况和覆盖范围上也表现出中等到极好的重测信度。这些结果为长期以来的概念提供了第一个证据,即微状态动力学代表稳定的神经特征(例如,da Cruz等人,2020;Murphy et al. 2020;Zanesco等人,2020;Kleinert et al. 2022)。微观状态特征在一周后与半年后一样可靠,但在同一天表现出更高的会话内可靠性,这一事实表明,毫秒级的大脑动态可能在每天的基础上发生一定程度的变化,但在很长一段时间内,它们的基本结构保持高度稳定。值得注意的是,我们发现不同EEG系统(64电极Brain Products系统vs. 30电极BioSemi系统)、记录长度(第一天3分钟vs.第二天2分钟)和认知状态(实验前vs.实验后)的重测可靠性很高,进一步强调了我们研究结果的稳健性。
与我们的假设相反,在所有测量、聚类过程和拟合过程中,微观状态转变的重测信度都很差到中等(ICCs大多< 0.500)。尽管先前的研究也发现,与持续时间、发生次数和覆盖范围相比,微状态转变的重测信度较低(Liu et al. 2020;Antonova et al. 2022),这些值仍在可接受范围内(ICCs大多> 0.600)。由于这些研究使用了不同的软件来分析微观状态,不同的计算模型可能会导致差异。Antonova及其同事(2022)推测,过渡概率的重测信度差(即使在不到1小时后)可能是由于用于计算过渡的事件的低可靠性。然而,这种解释在我们的研究中并不成立,因为事件显示出良好的可靠性。与持续时间、发生次数和覆盖率相比,转换代表了更复杂的微状态语法时间动态,涉及(至少)两种不同的微状态类型(例如,参见Lehmann et al. 2005)。考虑到复杂性自然地阻碍了可重复性,微状态转换的低可靠性似乎是一个合乎逻辑的结果。因此,关注微观状态转变的研究应该以使用大样本为目标。然而,应该指出的是,具体的过渡类型显示出可接受的短期和长期重新测试可靠性,即使在半年多之后。因此,一些转换类型也可能具有类似特征的质量,即使它们的可靠性比更简单的微状态动态(如持续时间、发生次数和覆盖率)要低。
正如假设的那样,在所有条件下,与大均值拟合相比,个体拟合产生的结果不太可靠,尤其是在覆盖率方面(见图2)。因此,我们的研究强烈支持Khanna及其同事(2014)的先前发现,但将其扩展到更大的样本。这些发现提供了证据,表明使用优势个体图而不是均值微状态图作为模板,将个体图分配给微状态类型,会导致个体之间存在相当大的不一致性,并最终降低微状态特征的可靠性。然而,应该注意的是,从个体拟合中获得的持续时间和发生率大多显示中等至良好的短期和长期重测信度。与此相关,微观状态特征在拟合过程中存在混合一致性,特别是在覆盖率方面,这可能是由于与大均值拟合相比,个体拟合的可靠性较低。个体拟合过程的主要问题是,作为模板的平均个体图在个体之间显示出很大的差异,导致将个体脑电图图分配给微状态类型时不一致,从而导致可靠性低。由于在不同的条件下使用了不同的大均值作为模板,在较低的尺度上也存在这一问题。然而,这个问题可以被认为是相对较小的,因为大均值几乎是完全一致的。如果有的话,不一致可能导致低估微观状态特征的真正重测可靠性。总之,我们因此建议在未来的研究中使用大均值拟合而不是个体拟合来获得可靠的微观状态特征,特别是在分析微观状态覆盖率时。
正如预期的那样,k-means聚类和AAHC都对微观状态特征产生了良好的整体短期和长期重测信度。虽然k-means聚类是更流行的方法,但AAHC似乎在微状态持续时间、发生次数和覆盖率方面产生了更优越的短期和长期重测信度。然而,在聚类过程中,微状态持续时间、发生次数和覆盖范围具有极好的一致性(参见Khanna et al. 2014),这支持了两种方法都是有效选择的观点。
这项研究的一个局限性是,前测是在早上进行的,后测是在下午早些时候进行的,在参与者完成了认知要求高的测试后。因此,这项研究可能低估了微观状态特征的真实短期重测信度,因为事后测量可能受到认知消耗和疲劳的影响。另一个限制是我们在第一天和第二天使用了不同的脑电图系统(64 vs 30电极)和记录时间(3 vs 2分钟)。同样,这意味着由于脑电图记录之间的系统差异,本研究可能低估了微观状态特征的真正长期重测可靠性。另一方面,这些差异证明了我们的发现在不同的认知状态、脑电图系统和记录时间下的可靠性。不同的记录长度可能与不同的唤醒水平有关,因为参与者即使在短暂的静息状态测量后也可能变得昏昏欲睡(例如,Tagliazucchi和Laufs 2014)。由于我们没有评估觉醒水平,我们无法控制这个可能的协变量。此外,应该指出的是,我们使用Koenig (2017;版本1.2),因此我们的发现可能不适用于其他软件获得的微状态特征。总之,本研究为EEG微态特征的短期和长期重测可靠性提供了强有力的证据,即使在6个月以上。此外,k均值聚类和AAHC都产生了可靠的结果,而与个体拟合相比,大均值拟合产生了更高的可靠性。这是标准化微状态研究的关键一步,最终将微状态用作基础研究和临床环境中的生物标志物。
数据可用性
本研究的数据和代码可以在OSF存储库(https://osf.io/hy8v7/)中免费获得。
参考文献
Al Zoubi O, Mayeli A, Tsuchiyagaito A等(2019)EEG微状态时间动态区分情绪和焦虑障碍个体与健康受试者。前哼神经科学13:56
Antonova E, Holding M, Suen HC等(2022)脑电微态:功能意义与短期重测信度。神经影像报告2:10,00,89
Artoni F, Maillard J, Britz J等(2022)脑电图微态动力学表明异丙酚诱导的意识丧失呈u型路径。神经影像学256:119156
王晓明,王晓明,王晓明,等(2014)移动脑电图在癫痫中的应用。[J]心理学报,91:30-35
Bigdely-Shamlo N, Mullen T, Kothe C等(2015)PREP流水线:大规模脑电分析的标准化预处理。前沿神经信息学9:16
李建军,李建军,李建军等(2013)孤独症儿童脑网络时间动态的早期变化。普通生物4:1-10
刘建军,刘建军,刘建军等(2020)脑电微态分析。科学代表10:1-9
Brunet D, Murray MM, Michel CM(2011)多通道脑电信号的时空分析:CARTOOL。计算机学报,2011:1
褚超,王鑫,蔡玲等(2020)帕金森病无药患者脑电微状态的时空分析。神经影像临床25:102132
Custo A, Van De Ville D, Wells WM等(2017)脑电图静息状态网络:微状态的源定位。大脑连接:671 - 682
D 'Croz-Baron DF, Baker M, Michel CM, Karp T(2019)青年自闭症谱系障碍静息状态的脑电微态分析。前哼神经科学13:173
张建军,张建军,李建军,等。(2010)脑电信号对脑电微态的影响。大脑拓扑学34:19-28
da Cruz JR, Favrod O, Roinishvili M et al (2020) EEG微状态是精神分裂症的候选内表型。十一:1 - 11
邓博尔斯克<e:1>,刘春华,李春华等(2019a)双相情感障碍患者静息状态大尺度脑网络动态改变。前沿精神病学10:826
damborska, Tomescu MI, Honzírková E等(2019b)脑电静息状态大尺度脑网络动态与抑郁症状相关。《前沿精神病学》10:548
de Bock R, Mackintosh AJ, Maier F等(2020)脑电图微状态对超高危患者精神病的生物标志物研究。精神病学杂志10:1-9
Delorme A, Makeig S (2004) EEGLAB:一个用于分析单次试验EEG动态的开源工具箱,包括独立分量分析。[J] .神经科学杂志,34 (4):9 - 21
DeYoung CG(2010)人格神经科学与特征生物学。《个人心理指南》4:1165-1180
Eid M, Gollwitzer M, Schmitt M(2011)统计与预测方法。Beltz, Weinheim,第547-548页
陈建军,陈建军,陈建军等(2009)脑电微状态对注意力缺陷/多动障碍的影响。生物精神病学,神经科学,神经影像学,7:814-823
fsamrat V, Scheltienne M, Brunet D等人(2022b) Pycrostates:一个用于研究EEG微状态的Python库。J开源软件7:4564
张建军,张建军,张建军,张建军,等(2009)脑电微观状态的频谱分解。哼大脑地图。https://doi.org/10.1002/hbm.25834
Fisher RA(1915)来自无限大总体的样本中相关系数值的频率分布。生物统计学10:507 - 521
Gajewski PD, Getzmann S, Bröde P et al .(2022)多特mund Vital研究中生物和生活方式因素对认知衰老和工作能力的影响:一项跨学科、横切面和纵向研究方案。JMIR Res协议11:e32352
Gamer M, Lemon J, Gamer MM等人(2012)打包“irr”。Var Coeff Interrater可靠协议22:1-32
Gargiulo G, Bifulco P, Calvo RA等人(2008)一种干电极移动脑电图系统。2008年IEEE生物医学电路与系统会议。IEEE,第273-276页
Gschwind M, Hardmeier M, Van De Ville D等(2016)自发性脑电图地形波动预测复发缓解型多发性硬化症的疾病状态。神经影像诊所12:466-477
kanna A, Pascual-Leone A, Farzan F(2014)脑电图静息状态微态特征的可靠性。PLoS ONE 9:e114163
Kleinert T, Nash K (2022) EEG静息网络较低的时间稳定性反映了特质攻击。大脑Topogr。https://doi.org/10.1007/s10548-022-00929-6
Kleinert T, Nash K, Leota J等(2022)稳定的心理加工反映了自我控制的心理。心理科学33:09567976221110136
Koenig T (2017) EEGLAB微状态插件。In: Microstates EEGLAB。https://www.thomaskoenig.ch/index.php/software/microstates-in-eeglab/getting-started
Koenig T, Lehmann D, Merlo MC等人(1999)急性精神分裂症患者休息时的异常脑电图脑微状态。欧洲精神病学临床神经科学249:205-211
Koenig T, Prichep L, Lehmann D et al .(2002)一毫秒一毫秒,一年一年:标准脑电图微观状态和发展阶段。神经影像学16:41-48
Koenig T, Kottlow M, Stein M, Melie-García L (2011) Ragu:一种基于全局随机化统计的脑电和脑磁图事件相关头皮场数据分析的免费工具。计算机学报,2011 (1):1 - 14
[辜tk,李明明(2016)可靠性研究中类内相关系数的选取与报告准则。][J]中华医学杂志(英文版):15 - 16
劳朱A,刘MP, McLoughlin G(2019)移动脑电图在神经发育障碍研究中的机遇与挑战。神经科学36:100635
Lehmann D(1971)人类α脑电图场的多通道地形。临床脑电图,神经物理,31 (3):439 - 449
Lehmann D, Faber PL, Galderisi S等人(2005)急性、未用药、首发精神分裂症的脑电图微状态持续时间和句法:一项多中心研究。精神病学杂志,神经影像138:141-156
刘健,徐军,邹刚等(2020)脑电微状态特征的信度与个体特异性。脑拓扑33:438-449
Michel CM, Koenig T (2018) EEG微状态作为研究全脑神经元网络时间动态的工具:综述。神经影像学180:577 - 593
Murphy M, Whitton AE, Deccy S等(2020)脑电图微观状态异常是重度抑郁症的状态和特征标志。神经精神药理学45:2030 - 2037
Murray MM, Brunet D, Michel CM(2008)地形ERP分析:一步一步的教程回顾。脑拓扑,20:249-264
李建军,李建军,李建军,等(2009)基于脑电的神经网络研究。心理生物学[j]
张晓明,张晓明,张晓明,等。焦虑干扰行为监测:行为相关电位、脑电图微状态的综合研究。Cereb皮层。https://doi.org/10.1093/cercor/bhac307
Newson JJ, Thiagarajan TC(2019)精神疾病的脑电图频带:静息状态研究综述。前哼神经科学12:521
Nishida K, Morishima Y, Yoshimura M等人(2013)脑电图微状态与额颞叶痴呆、精神分裂症和阿尔茨海默病的显著性和额顶叶网络相关。临床神经生理学124:1106-1114
Pascual-Marqui RD, Michel CM, Lehmann D(1995)脑电活动的微观状态分割:模型估计和验证。生物工程学报,42 (2):658 - 665
张志强,张志强,张志强,等(2019)ICLabel:脑电独立成分分类器,数据集和网站。神经影像学198:181 - 197
Popov T, Tröndle M, Baranczuk-Turska Z等(2023)青年人和老年人静息状态脑电图的重测信度。心理生理学。https://doi.org/10.1111/psyp.14268
Schiller B, Gianotti LRR, Baumgartner T等人(2016)通过电子神经成像识别IAT中的心理过程来记录社会心理。科学进展,113:2786-2791
Schiller B, Kleinert T, Teige-Mocigemba S等(2020)静息脑电图网络的时间动态与亲社会性相关。科学代表10:1-10
Tagliazucchi E, Laufs H(2014)从典型的fMRI静息状态数据解码清醒水平揭示了清醒和睡眠之间可靠的漂移。神经元82:695 - 708
李春华,李春华,李春华等(2020)脑电微态复杂度对阿尔茨海默病早期诊断的影响。科学代表10:1-10
Zanesco AP, King BG, Skwara AC, Saron CD(2020)静息脑电图微观状态时间动态的人内和人之间相关性。神经影像学211:116631
Zappasodi F, Croce P, Giordani A等(2017)脑电微状态对急性脑卒中的预后价值。脑拓扑,30:698-710
Zappasodi F, Perrucci MG, Saggino A等人(2019)脑电图微状态区分流体推理的认知成分。神经影像学189:560 - 573
资金
由Projekt DEAL支持和组织的开放获取资金。多特蒙德生命研究由莱布尼茨工作环境和人为因素研究中心(IfADo)资助。
作者信息
作者及单位
贡献
所有作者都对这项研究进行了概念化。TK写了最初的草稿。所有作者都审阅了手稿。传统知识提供了方法。所有作者都对数据分析做出了贡献。EW监督数据收集。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益冲突。
伦理批准
该研究符合《赫尔辛基宣言》,并得到了莱布尼茨工作环境与人为因素研究中心(IfADo)当地伦理委员会的批准。
额外的信息
编辑:Christoph Michel。
出版商的注意
施普林格自然对已出版的地图和机构关系的管辖权要求保持中立。
补充信息
以下是电子补充材料的链接。
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。要查看本许可的副本,请访问http://creativecommons.org/licenses/by/4.0/。