摘要
µ-阿片肽受体(MOPR)刺激改变呼吸、镇痛和奖励行为,并可诱导药物滥用和过量1,2,3。尽管具有明显的重要性,但MOPR调节完满行为的内源性机制仍然未知。在这里,我们报告了内源性MOPR对小鼠奖励消耗的调节通过特定的中缝背到伏隔核的投影起作用。MOPR介导的中隔末端抑制是决定终性反应的必要和充分条件,而选择性含有脑啡肽的伏隔核群在奖赏消耗之前被参与,这表明局部脑啡肽释放是内源性MOPR配体的来源。伏隔核脑啡肽神经元的选择性调节和crispr - cas9介导的脑啡肽破坏证实了这一发现。这些结果分离出一个基本的内源性阿片回路,用于依赖状态的消费行为,并提出了阿片调节奖励的其他机制。
这是订阅内容的预览,可通过您的机构访问
访问选项
访问Nature和其他54种Nature组合期刊
获取自然+,我们最具价值的在线订阅
99€/ 30天
随时取消
中国客户的订阅信息
我们有一个专门的网站为我们的中国客户。请登录naturechina.com订阅本刊。
购买这篇文章
- 在Springer Link上购买
- 即时访问全文PDF
价格可能会在结账时计算当地税收





类似的内容被其他人浏览
数据可用性
支持当前研究的行为数据集可应要求从作者处获得。本文提供了源数据。
代码的可用性
创建了自定义MATLAB分析和代码,以适当地组织,处理和组合测光和单光子记录数据与相关行为数据。图2、4的光度测定和单光子成像分析代码可在Github (https://github.com/BruchasLab)上获得。
参考文献
疾病控制和预防中心。疾控中心查房:处方药过量——美国的流行病。Morb。凡人。工作。众议员61,10-13(2012)。
Volkow, N., Benveniste, H. & McLellan, A. T.阿片类药物在慢性疼痛中的使用和滥用。为基础。中华医学杂志,69,451-465(2018)。
魏,A. D.和拉米雷斯,j . m .。突触前机制和KCNQ钾通道调节阿片类药物抑制呼吸驱动。前面。物理学报,2016,38(4):481 - 481。
Kelley, A. E, Baldo, B. A, Pratt, W. E. A提出下丘脑-丘脑-纹状体轴与能量平衡、觉醒和食物奖励的整合有关。[j] .中华神经医学杂志,2003,24(5):559 - 564。
吗啡类疾病的治疗。印度医学杂志,26,65 - 68(1891)。
Herkenham, M. & Pert, C. B.大鼠脑中阿片受体的体外放射自显影显示了“阿片能”通路的位点。自然科学进展。美国77,5532-5536(1980)。
马萨里,N, Morón, J. A.和Al-Hasani, R.阿片类药物滥用的触发因素:慢性疼痛和应激失调中脑边缘通路和kappa阿片类系统。前面。神经科学,2018,48(2016)。
动机和神经肽能中枢:伏隔核壳内的解剖和功能多样性。神经科学学报,39(4),344 - 344(2019)。
Hughes, J.等。鉴定来自大脑的两种相关的具有强效阿片激动剂活性的五肽。自然258,577-580(1975)。
Simantov, R. & Snyder, H.牛脑中吗啡样肽“脑啡肽”的分离和结构鉴定。生命科学18,781-787(1976)。
Bakshi, v.p. & Kelley, A. E.阿片刺激腹侧纹状体诱导进食:阿片受体亚型的作用j .杂志。判例。265,1253-1260(1993)。
纹状体亚区μ-阿片受体通过平行但不同的奖励机制介导配对键的形成。中国生物医学工程学报,33(3):939 - 949(2013)。
Castro, d.c.和Berridge, k.c.伏隔核壳中的阿片享乐热点:增强甜味“喜欢”和“想要”的mu、delta和kappa图。中国生物医学工程学报,2014,32(4):559 - 559。
崔,Y.等。纹状体直接通路神经元亚群中μ-阿片受体的靶向表达可恢复阿片奖赏。神经科学学报,17,254-261(2014)。
bodana, R. J, Glass, M. J, Ragnauth, A. & Cooper, M. L. General,µ和κ阿片样物质拮抗剂在剥夺、葡萄糖和美味条件下改变伏隔核的食物摄入。中华医学杂志,2004,32(1)。
Kelley, A. E., Bless, E. P. & Swanson, C. J.:阿片类拮抗剂注入伏隔核对大鼠摄食和蔗糖饮用影响的研究。j .杂志。[j] .自然科学与工程学报,1998,14(4):387 - 398。
克莱默,t.h.等人。新型肽类阿片拮抗剂:体外和体内的药理学特性。j .杂志。法典。249,544-551(1989)。
Tervo, d.g.r.等。设计AAV变体允许有效的逆行访问投射神经元。《神经学报》(英文版),2016年6月。
赵,Z.-Q。et al。中枢5 -羟色胺能神经元对阿片镇痛有不同的要求,但对吗啡耐受或吗啡奖励没有要求。自然科学进展。《美国》104,14519-14524(2007)。
陆地,b。b。等。中缝背核kappa阿片受体的激活介导应激的不良反应并恢复药物寻求。自然科学进展。美国106,1918 - 19173(2009)。
Nectow, a.r.等。识别控制进食的脑干回路。170室,429-442。e11(2017)。
黄坤文等。中缝背核的分子和解剖结构。中国生物医学工程学报(英文版),2016(6)。
Gunaydin, l.a.等。社会行为背后的自然神经投射动力学。Cell 157, 1535-1551(2014)。
Siuda, e.r.等人。阿片信号和行为的时空控制。神经学报,86,923-935(2015)。
Ran, f.a.等。利用金黄色葡萄球菌Cas9进行体内基因组编辑。自然,520,186-191(2015)。
汉克,a.c.等人。条件单载体CRISPR/SaCas9病毒在成年小鼠神经系统中的高效诱变。牢房代表30,4303-4316。e6(2020)。
al - hasani, R.等。光诱发阿片肽释放的体内检测。中国生物医学工程学报,2018,36(5):481 - 481。
maldondo - irizarry, c.s., Swanson, c.j. & Kelley, a.e.伏隔核壳中的谷氨酸受体通过外侧下丘脑控制摄食行为。中华神经科学杂志,15,(1995)。
Vachez, Y. M.等。腹侧树状神经元抑制伏隔放电,促进奖励消耗。神经科学学报,24,379-390(2021)。
卡斯特罗,D. C.,特里,R. A.和贝里奇,K. C. .伏隔核喙侧区域的食欲素增强了对蔗糖的“喜爱”和摄入,但尾侧壳中的东莨菪碱使“喜爱”转向“厌恶”和“恐惧”。神经精神药理,41,2101-2111(2016)。
乔治斯库等人。下丘脑神经肽黑色素浓缩激素在伏隔核中调节摄食行为和强迫游泳表现。神经科学学报,25,2933-2940(2005)。
Lim, b.k., Huang, k.w., Grueter, b.a., Rothwell, p.e.和Malenka, r.c.。快感缺乏需要mc4r介导的突触适应。《自然》487,183-189(2012)。
奥康纳,e.c.等。伏隔D1R神经元投射到外侧下丘脑授权进食。神经元88,553-564(2015)。
Berthoud H.-R。下丘脑外侧作为代谢和环境需求的整合者:从电自我刺激到光遗传学。杂志。行为学报,2004,29-39(2011)。
Corre, J.等。多巴胺神经元向伏隔核内侧壳的突起驱动海洛因强化。中国生物医学工程学报,2018,39(1)。
Di Chiara, G. & Imperato, A.人类滥用药物会优先增加自由活动大鼠中脑边缘系统突触多巴胺的浓度。自然科学进展。《美国》85,5274-5278(1988)。
腹侧苍白球和享乐奖励:蔗糖“喜好”和食物摄入的神经化学图谱。中国生物医学工程学报,2009,32(2):444 - 444。
陆地,b。b。等。应激的烦躁成分是通过激活促啡-卡帕-阿片系统来编码的。神经科学学报,28(2008)。
Zelikowsky, M.等。神经肽Tac2控制着由慢性社会隔离压力引起的分布式脑状态。173号牢房,1265-1279。e19(2018)。
帕克,k.e.等人。一个限制奖励动机的旁侧VTA伤害感受素回路。178室,653-671。e19(2019)。
al - hasani, R.等。不同亚群的伏隔核运动啡神经元驱动厌恶和奖励。神经学报,87,1063-1077(2015)。
马萨里等人。疼痛引起的负面影响是通过伏隔核kappa阿片系统的募集介导的。神经元102,564-573。e6(2019)。
费特利,t.l.等。胰岛素双向改变NAc谷氨酸能传递:胰岛素受体激活、内源性阿片和谷氨酸释放之间的相互作用。中国生物医学工程学报,2016,33(4):559 - 561。
施密德,c.l.等。偏倚因子和治疗窗口相关预测更安全的阿片类镇痛药。171号牢房,1165-1175号。e13(2017)。
阿片肽对下丘脑外侧和腹侧被盖区-黑质自我刺激奖赏位点的影响。生物医学杂志,87,180-191(1988)。
Lemos, J. C., Roth, C.和Chavkin, C. kappa阿片受体激活引发的信号事件:使用磷酸化选择性KOR, p38 MAPK和KIR 3.1抗体的定量和免疫共定位。方法生物医学杂志,717,197-219(2011)。
Banghart, M. R.和Sabatini, B. L.神经组织中阿片样物质时空精确递送的光激活神经肽。神经元学报,73,249-259(2012)。
巴纳拉,S.等。用于烟碱光学药理学的光活化药物。学报,15,347-350(2018)。
张勇,等。无电池,重量轻,可注射微系统在体内无线药理学和光遗传学。自然科学进展。美国116,21427-21437(2019)。
父权制,t等。设计基因编码传感器的多巴胺动态超快神经元成像。科学360,eaat4422(2018)。
Sun, F.等。一种基因编码的荧光传感器能够快速、特异地检测果蝇、鱼类和小鼠体内的多巴胺。174号,481-496号牢房。e19(2018)。
王峰等。RNAscope。[j] .医学诊断,2014,22 - 29(2012)。
马蒂斯,h.w.等。缺乏微阿片受体基因小鼠吗啡诱导的镇痛、奖励效应和戒断症状的丧失《自然》383,819-823(1996)。
J. G. McCall等人。CRH参与蓝斑去肾上腺素能系统介导应激性焦虑。[j] .中国科学:自然科学,2015(5)。
雷森德斯,s.l.等。用头戴式显微镜和慢性植入透镜观察哺乳动物自然行为过程中皮层、皮层下和脑深部神经回路的动态变化。Nat. Protoc. 11, 566-597(2016)。
周,P.等。从显微内镜视频数据中高效准确地提取体内钙信号。中国生物医学工程学报,2018,38(6):481 - 481。
致谢
我们感谢L. Lawson, D. Blumenthal, M. Chung, T. Hobbs和C. Pizzano对动物群体的维护;Bruchas实验室,Stuber实验室和NAPE中心内的多名学员和教师进行有益的讨论;B.对Oprm1fl/fl小鼠进行Kieffer;G. Scherrer为penk - cree小鼠。dc由NIH拨款NS007205, DA043999, DA049862和DA051489资助。C.E.P.由NIH拨款DA051124资助。M.A.R.由NIH拨款DK121883和NARSAD青年研究者奖资助。J.A.M.由NIH拨款DA041781, DA042499和DA045463资助。G.D.S.由DA032750、DA038168和DA048736资助。M.R.B.由NIH拨款R37DA033396和R61DA051489以及Mallinckrodt捐赠教授资助。M.R.B, G.D.S.和L.S.Z.由NIH拨款P30DA048736资助。
作者信息
作者及单位
贡献
dc设计并进行实验,收集和分析数据,并撰写手稿。c。s。o。e。t。z。a。g。做了实验,收集了数据。M.A.R.收集并分析了电生理数据。A.C.H.和L.S.Z.设计并分析了CRISPR病毒。C.E.P设计并分析了纤维光度测定数据。sccp设计并分析了单光子数据。M.R.B.和J.A.M.为Oprm1fl/fl × Penk和Oprm1fl/fl × Pdyn小鼠细胞系的生成提供了资源。j.a.m.、L.S.Z.和G.D.S.帮助设计实验、讨论结果和撰写手稿。M.R.B.帮助领导了实验的设计、分析、监督、讨论结果、提供资源和撰写手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益冲突。
额外的信息
《自然》杂志感谢Brigitte Kieffer, Christian lscher和其他匿名审稿人对这项工作的同行评议所做的贡献。
施普林格·自然对已出版地图的管辖权要求和机构关系保持中立。
扩展数据图和表
扩展数据图1 macsh中的内源性MOPR激活对于增强状态依赖的完善行为是必要的。
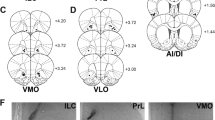
a.每个微喷油器尖端位置图(蓝色=与无车相比进气抑制,绿色=与无车相比进气增强)。b.向伏隔核(NAc)内侧壳周围区域注射载体(灰色,顶部)或药物(CTAP,蓝色,底部)的示意图。c.与注射在NAc内侧壳外的对照日(n = 8)相比,CTAP(蓝色)对随意进食或饥饿感增强摄入没有影响。d. NAc内侧壳中Pdyn、Penk和Oprm1的原位杂交(刻度条= 200µm)。e, f. macsh中MOPR表达的定量。g. Oprm1fl/fl与Pdyn-Cre小鼠杂交示意图。h, i. Oprm1fl/fl x Pdyn- cre小鼠NAc内壳(标尺= 200µm)中Pdyn、Penk和Oprm1的原位杂交(h)和定量(i)。j.与Pdyn-Cre-同窝对照小鼠(n = 9 Cre-, 10 Cre+)相比,Pdyn-Cre+神经元上mprr的缺失并未破坏正常的自由活动或食物剥夺增加的摄入量。k和l. Oprm1fl/fl x Penk- cre小鼠NAc内壳(标尺= 200µm) Pdyn、Penk和Oprm1的原位杂交(k)和定量(l)。m. rAAV5-CMV-Cre-GFP注射到Oprm1fl/fl小鼠NAc内侧壳的示意图和图像。n.局部MOPR缺失联合病毒传播图示意图。o.左图为AAV2retro-CMV-myc-NLS-Cre或AAV2retro-GFP-Cre注射到NAc的示意图(上)和图(下);中缝背核逆行标记细胞(右)。所有误差条表示±SEM, n =生物独立的小鼠或细胞(f, i, l)。中位数用橙色条标记。事后p值由Sidak多重比较的双向方差分析得出(c, j)。
图2 macsh中内源性MOPR激活对于增强状态依赖的回避行为是必要的。
a.高架零迷宫(EZM)试验示意图。小鼠在适应试验室(无约束)或约束应激(约束)30分钟后进行测试。b.野生型(WT,左)或Oprm1 KO (KO,右)在没有约束(上)或约束30分钟(下)后在EZM张开的手臂上花费的时间示例热图。c.未受约束的WT小鼠在张开的双臂中进行约30%的EZM试验。受到约束压力的小鼠的探索次数显著减少至10%。纳洛酮预处理可预防约束性回避。Oprm1 KO小鼠在约束后不表现张开手臂回避行为。约束后,小鼠对张开双臂的回避表现正常(n = 9只WT无约束,9只WT有约束,8只Oprm1 KO无约束,7只Oprm1 KO有约束,8只Oprm1fl/fl × Penk-Cre-有约束,9只Oprm1fl/fl × Penk-Cre+有约束)。d.食物剥夺或限制后的摄食量测定示意图。e.被剥夺食物的小鼠相对于自由试验日的摄入量正常增加。与不受约束的小鼠相比,受到约束的小鼠的食物摄入量没有增加(n = 11只被剥夺,10只被限制)。所有误差条代表±SEM和n =生物独立小鼠。中位数用橙色条表示。事后p值由Sidak多重比较的双向方差分析得出(c, e)。
图3 LDRN扩展数据Penk-NAc预测表示mopr。
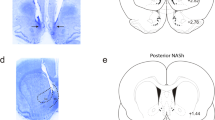
a.注射到伏隔核内侧壳后,Penk-Cre+小鼠杏仁核逆行荧光标记细胞。b.(左)Oprm1、Slc32a1和Slc17a6在DRN中的原位杂交(比例尺= 200µm)。放大和通道分离图像(右)的红色方块在左面板。d、e.伏隔核壳局部注射aav2retror - gfp - cre示意图和图像(比例尺= 200µm)。放大后的图像被指定为红色(i)和黄色(ii)框。f.(左)中缝背核Oprm1、Penk和Cre的原位杂交(比例尺= 200µm)。放大和通道分离图像(右)的红色方块在左面板。g.面板f的原位定量。h. CTb实验示意图。i.将荧光标记的CTb注射到macsh中(标尺= 200µm)。j.中缝背核中观察到CTb标记的细胞,包括图2a中标记脑啡肽神经元的外侧部位(标尺= 200µm)。红色方块显示放大的图像(右),带有标记的单元格(用白色箭头表示)。所有误差条表示±SEM和n =生物独立细胞。
图4非drn位点不介导食物剥夺对蔗糖消耗的增强作用。
a. Oprm1fl/fl小鼠室旁丘脑局部MOPR缺失并未减少食物剥夺后增加的摄食(n = 8,配对t检验t(7) = 9.634, p < 0.001)。b.腹侧苍白球或杏仁核基底内侧的局部半胱天冬酶消融示意图。c.相对于Cre对照组小鼠(n = 8 Cre-, 9 VP, 7 BMA),局部和细胞类型特异性消融VP或BMA的脑啡肽神经元并没有减少食物剥夺的增加摄入量。d.腹侧苍白球Caspase注射部位确认(比例尺= 200µm)。共注入AAV2-FLEX-taCas3-TEPp和AAV5-hsyn-EYFP进行细胞类型特异性缺失和非特异性标记。e, f.将AAV5-Ef1a-DIO-EYFP局部注射到DRNPenk(标尺= 200µm)的示意图和图像。g.来自e的背缝投影纤维图像(比例尺= 200µm)。h. DNQX的应用降低了oEPSC振幅(n = 8)。蓝色阴影区域表示光刺激的持续时间。i.应用gabazine降低了oIPSC振幅(n = 5)。所有误差条表示±SEM, n =生物独立的小鼠或细胞(h, i)。事后p值来自Sidak多重比较(c)的双向方差分析(two -way ANOVA)或双尾配对t检验(h, i)。
图5 LDRN扩展数据MOPR- macsh投射活性以阿片受体依赖的方式受蔗糖消耗的负调节。
a.光度法示意图和自愿蔗糖消耗范例。b. DRNPenk中GCaMP6s的表达(左,标尺= 200µm)和mNAcSh中纤维的放置(标尺= 200µm)。c.相对于自由摄取量(白色),FD增加了食物摄取量(绿色),并被全身纳洛酮(蓝色,n = 8)所减少。d.自由摄取量/生理盐水(白色)、剥夺食物/生理盐水(绿色)和剥夺食物/纳洛酮(蓝色)测试日的饮食微观结构。在食物剥夺后,大多数蔗糖颗粒在多次颗粒回合中被消耗(左图),并且每次多次颗粒回合被吃掉更多的颗粒(右图)。这种饮食行为的转变被纳洛酮削弱了。e.光度实验中405nm和470nm的原始通道示例。f.在剥夺食物的测试日,突出显示特定单颗粒(黑色)或多颗粒(绿色)摄入事件的生df/f痕迹示例。顶部的彩色框扩展了下面轨迹的颜色匹配部分。橙色线表示颗粒消耗的开始。g.在FD/生理盐水条件下(绿色)和FD/纳洛酮条件下(蓝色),平均z得分轨迹与LDRNPenk-mNAcSh终端多粒消耗的开始一致。h.自由测试当天的平均z得分轨迹(暗线)和误差。当GCaMP活性与随意进食的每个颗粒的起始时间一致时,活性未观察到显著偏差(黑色,顶部)。当对准多颗粒回合开始时,没有偏离基线活动(底部棕色)。i.调节食物摄入范式示意图。每90-150秒非偶然递送两粒颗粒,持续30分钟。小鼠在FD/生理盐水或FD/纳洛酮条件下进行测试。j.在调节摄入模式下食用的蔗糖颗粒总数。小鼠在食物剥夺/生理盐水测试日(绿色)明显吃了更多的颗粒,在全身纳洛酮(蓝色)(n = 10) k后减少到基线水平。平均z得分痕迹与LDRNPenk-mNAcSh多颗粒消耗的开始一致。食物剥夺/生理盐水痕迹(绿色)显示出快速和持续的抑制。食物剥夺/纳洛酮痕迹(蓝色)显示反应迟钝。1 .所有被试小鼠在剥夺食物/生理盐水(绿色)或剥夺食物/纳洛酮测试日的个体试验热图。橙色线表示颗粒消耗的开始。m.量化多球球回合开始前20秒和开始后20秒的平均z分数。FD/生理盐水痕迹(绿色)显示GCaMP6s活性显著降低,而FD/纳洛酮痕迹(蓝色)没有(n = 10)。所有误差条代表±SEM和n =生物独立小鼠。事后p值由Sidak多重比较的双向方差分析得出(c, j, m)。
图6 LDRN上MOPR的激活MOPR-mNAcSh足以增强圆满行为。
a.尾浸试验示意图。小鼠在0时进行测试,注射吗啡(5mg/kg, s.c),然后每10分钟测试一次,持续60分钟,然后在90分钟再次测试。b. WT, Oprm1 KO和Oprm1 KO x Penk-Cre救援小鼠在0时均显示相似的基线反应。吗啡给药后,WT小鼠甩尾潜伏期明显增加,而Oprm1 KO和Oprm1 KO x Penk-Cre对吗啡小鼠无镇痛反应(n = 5 WT, 2 Oprm1 KO, 6 Oprm1 KO x Penk-Cre;WT/T0 vs Oprm1 KO/T0 p = 0.116, WT/T0 vs Oprm1 KO x Penk-Cre rescue/T0 p = 0.063, WT/T10 vs Oprm1 KO/T10 p < 0.001, WT/T10 vs Oprm1 KO x Penk-Cre rescue/T10 p < 0.001, WT/T90 vs Oprm1 KO/T90 p < 0.001, WT/T90 vs Oprm1 KO x Penk-Cre rescue/T90 p < 0.001)。WT与Oprm1 KO的统计差异为(***),WT与Oprm1 KO x Penk-Cre救援的统计差异为(+++)。c.单个老鼠舔食事件的栅格图,通过试验分开。只包括老鼠被舔的实验。d. ChR2实验示意图。e. eyfp标记的ChR2在LDRNPenk细胞体中的表达(左,标尺= 200µm)和纤维在mNAcSh中的放置(右,标尺= 200µm)。f.在无激光条件下,Penk-Cre-和Penk-Cre+小鼠舔糖溶液的量相似。ChR2光刺激没有减少舔舐(n = 7 Cre-, 6 Cre+)。g.在WD/无激光条件下,Penk-Cre-和Penk-Cre+小鼠舔食糖溶液的量相似。相比之下,ChR2光刺激显著减少Cre+舔舐,但不减少Cre舔舐。h. WD条件下一只Penk-Cre+小鼠个体舔食事件的栅格图,以试验分隔。只包括老鼠被舔的实验。与无激光试验日相比,ChR2光刺激破坏了舔鼠行为。所有误差条表示±SEM, n =生物独立的小鼠或细胞(a)。事后p值来自Sidak多重比较的双向方差分析(c, f, g)。
扩展数据图7 macsh脑啡肽能群受生理状态调节,并增强完满行为。
a.在随意进食和剥夺食物的测试日期间消耗的蔗糖(n = 5)。迷你头戴式耳机没有破坏正常的摄入行为。b.单个细胞轨迹与多颗粒回合起始一致的例子。c.在没有食物的测试日,所有被跟踪的细胞的平均痕迹与大约消耗一致。d.任意状态下多球团簇的TSNE图。e.启动激活神经元的平均轨迹(簇1)。f.启动前激活神经元的平均轨迹(簇2)。g.脑啡肽神经元亚群的总比例和重叠,由多颗粒(粉色)、食物嗅(橙色)、饲养(蓝色)和梳理(棕色)调节。h.通过kmeans聚类排序的食物嗅闻行为的TSNE(左)和平均z得分轨迹(右)。i.通过kmeans聚类对饲养行为的TSNE(左)和平均z得分轨迹(右)进行排序。j.通过kmeans聚类排序梳理行为的TSNE(左)和平均z得分轨迹(右)。所有误差条表示±SEM (a),或者SEM由迹线(c, e, f, h, i, j)周围的阴影区域表示。
图8糖消耗过程中mmnacsh或pomc神经元的调节。
a. hM3D(Gi)(左)和hM3D(Gq)(右)DREADD实验示意图。b. hM3D(Gi)(左)和hM3D(Gq)(右)实验中,macsh中mcherry标记的脑啡肽细胞的荧光显微照片(比尺= 200µm)。c. CNO注射抑制Cre+小鼠的饥饿感,增加摄入,但对Cre-小鼠没有影响(n = 15 Cre-, 12 Cre+)。d. CNO注射增加了Penk-Cre+小鼠的摄食量,高于已经升高的食物剥夺摄食量,但对Penk-Cre-小鼠没有影响(n = 7 Cre-, 10 Cre+)。e.全身CNO给药(3mg/kg, i.p.)抑制了Penk-Cre+小鼠已经很低的随意摄入量,但没有减少Penk-Cre-小鼠的摄入量。f.全身CNO给药(3mg/kg, i.p.p)对Penk-Cre-或Penk-Cre+小鼠的随意摄入量没有影响。g. POMC-Cre小鼠弓形核注射Gq或Gi DREADD。h. mccherry标记的弓形核中表达dreadd的细胞的显微象形图(标尺= 200 μm)。i (k。在Cre-或Cre+小鼠中,Gi和Gq刺激对随意进食或剥夺食物摄入均无影响(n = 7 Cre-, 7 Gq, 9 Gi)。所有误差条代表±SEM和n =生物独立小鼠。事后p值由Sidak多重比较(c, d, e, f, i, j, k)的双向方差分析得出。
扩展数据图9 macsh内的内源性mu-阿片肽是增强完成人行为所必需的。
a. machsh caspase注射FISH(比例尺= 200µm)。b. (a)的FISH定量。c. mmnacsh CRISPR注射的FISH(比例尺= 200µm)。d. (c)的FISH定量。e. CRISPR病毒开发和验证示意图。f. GFP+细胞核测序:(上)sgPenk序列,PAM下划线,SaCas9切割位点用黑色箭头表示。(中)Sanger测序结果显示从SaCas9预测切割位置开始的多个峰。(下)切割位点前十个突变,左边是发生的百分比。插入:强调。删除:用“-”号标记。SaCas9插入后的受影响部位:棕色阴影。g.野生型(黑色)、缺失(棕色)、插入(粉色)和碱基变化(白色)占GFP+和GFP-核总读取量的百分比。h. GFP+细胞核中Penk插入(粉色)和缺失(棕色)的频率分布。Sanger测序结果显示,SaCas9预测切割位点处没有异常峰。j.单侧击中或双侧未击中NAc内侧壳并缺失CRISPR介导的脑啡肽(enkephalin)并没有减少食物剥夺,增加摄入(n = 4)。k.中缝背核CRISPR病毒表达的荧光电镜图。l.中缝背核中脑啡肽的缺失并没有减少食物剥夺后的增加摄入量(n = 8)。NAc内侧壳中肌啡肽的缺失并没有减少食物剥夺后的增加摄入量(n = 7)。n.在CRISPR/生理盐水(橙色)或对照/生理盐水(灰色)试验日中所有受试小鼠的个体试验热图。橙色线表示颗粒消耗的开始。o.平均z评分与全身纳洛酮注射后LDRNPenk-mNAcSh多粒消耗的开始一致。对照组小鼠(蓝色)表现出迟钝的抑制作用。表达crispr的微量(棕色)表现出可忽略不计的阶段性抑制。p.在CRISPR/纳洛酮(橙色)或对照/纳洛酮(蓝色)测试日中所有受测小鼠的单个试验热图。q.量化多球球回合开始前20秒和开始后20秒的平均z分数。控制线(蓝色)和CRISPR线(棕色)都没有显示出GCaMP活性的显著偏差。一些小鼠在纳洛酮治疗后没有舔食,因此没有被纳入本分析(CRIPSR n = 3, Control n = 3)。所有误差条代表±SEM和n =生物独立的小鼠或细胞(b, d)。事后p值来自Sidak多重比较的双向方差分析(q)或双尾配对t检验(j, 1, m)。
扩展数据图10 A LDRNMOPR-mNAcShPenk回路介导完善行为的增强。
自愿蔗糖消耗任务示意图(左上)和LDRN-mNAcSh投影(右上)。ldrnmopr - macshpenk手法对行为(左下)和假设生理示意图(右下)的影响。
权利和权限
关于本文
引用本文
卡斯特罗,d.c.,奥斯威尔,c.s.,张,E.T.等。内源性阿片回路决定状态依赖性奖励消耗。《自然》,598,646-651(2021)。https://doi.org/10.1038/s41586-021-04013-0
收稿日期:2021年1月20日
录用日期:2021年9月9日
发布日期:2021年10月13日
发行日期:2021年10月28日
DOI: https://doi.org/10.1038/s41586 - 021 - 04013 - 0
这篇文章是由
-
体内光药理学与笼养mu阿片受体激动剂驱动行为的快速变化
Nature Methods (2023)
-
下丘脑外侧前脑啡肽神经元驱动与消极情绪状态相关的威胁诱导的暴饮暴食
自然通讯(2023)
-
人类OPRM1和小鼠OPRM1启动子驱动的病毒构建物遗传进入μ-阿片能细胞类型
自然通讯(2023)
-
突触前受体的局部调节控制神经元的通讯和行为
Nature Reviews Neuroscience (2022)
-
阿片门控的丘脑伏隔回路抑制小鼠的奖赏寻求
自然通讯(2022)
评论
通过提交评论,您同意遵守我们的条款和社区准则。如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。