摘要
分子开关蛋白在不同状态之间的循环由相反的调节因子1,2控制,是生物信号转导的核心。当开关蛋白在高度连接的相互作用网络中起作用时,当不同的过程共享共同的调节因子时,如何实现功能特异性的基本问题就出现了。本研究表明,酿酒酵母(Saccharomyces cerevisiae)中GTPase小开关蛋白Gsp1(人类蛋白RAN的同源物)4的功能特异性与生物过程对Gsp1 (RAN)开关周期的不同动力学的差异敏感性有关。我们对Gsp1 (RAN)的单个蛋白质相互作用界面进行了55个靶向点突变,并通过定量遗传学和物理相互作用图谱显示,Gsp1 (RAN)界面扰动具有广泛的细胞后果。与预期相反,界面突变组的细胞效应是由其对GTPase转换周期动力学参数的生物物理影响而不是由目标界面影响。相反,我们表明,界面突变变构调整GTPase循环动力学。这些结果表明,蛋白质伴侣结合或远端位点的翻译后修饰可以作为GTPase转换的变构调节因子。类似的机制可能是其他gtp酶和其他生物开关调控的基础。此外,我们确定分子扰动定量后果的综合平台可能有助于解释针对中心分子开关的疾病突变的影响。
这是订阅内容的预览,可通过您的机构访问
访问选项
访问Nature和其他54种Nature组合期刊
获取自然+,我们最具价值的在线订阅
99€/ 30天
随时取消
中国客户的订阅信息
我们有一个专门的网站为我们的中国客户。请登录naturechina.com订阅本刊。
购买这篇文章
- 在Springer Link上购买
- 即时访问全文PDF
价格可能会在结账时计算当地税收




类似的内容被其他人浏览
数据可用性
质谱蛋白质组学数据已存储到PRIDE蛋白质组学数据存储库中,数据集标识符为PXD016338,可作为补充表使用。原始生物物理数据(循环动力学、圆二色光谱和核磁共振)、E-MAP s分数、缩放SGA分数及其相关性可从https://github.com/tinaperica/Gsp1_manuscript/tree/master/Data获得。支持本研究结果的所有其他数据均可在论文及其补充文件中获得。本文提供了源数据。
代码的可用性
自定义编写的R和Python脚本可以在https://github.com/tinaperica/Gsp1_manuscript上获得,没有任何限制。
参考文献
Ferrell, J. E. & Ha, S. H.超灵敏度第一部分:米夏埃尔反应和零阶超灵敏度。学生物化学的发展趋势。科学通报,39(2014),496-503。
生物系统中共价修饰引起的放大敏感性。自然科学进展。美国78,6840-6844(1981)。
Eisenberg, D., Marcotte, E. M., Xenarios, I. & Yeates, T. O.在后基因组时代的蛋白质功能。《自然》,2004,8(5),823-826。
Rush, m.g, Drivas, G和D 'Eustachio, P.小核gtp酶运行:运行多少?生物论文18,103-112(1996)。
Collins, S. R, Schuldiner, M, Krogan, N. J. & Weissman, J. S.一种提取和分析大规模定量epistatic交互数据的策略。中国生物医学工程学报,2009,32 (1);
布拉伯格,H.等。遗传相互作用作图有助于蛋白质复合物的整体结构确定。科学通报,2016,(5):481 - 481。
布拉伯格,H.等。从结构到系统:RNA聚合酶II的高分辨率,定量遗传分析。Cell 154, 775-788(2013)。
《时代:主题与变奏》。咕咕叫。中国生物医学工程学报,32(2):481 - 481(2002)。
Bischoff, f.r. & Ponstingl, H. in The Small GTPase Ran Vol. 1(编辑Rush, M. & D 'Eustachio, P.) 163-176 (Springer, 2001);https://doi.org/10.1007/978-1-4615-1501-2_9
gtp结合蛋白Ran/TC4是蛋白质进入细胞核所必需的。自然365,661-663(1993)。
Köhler, A. & Hurt, E.从细胞核向细胞质输出RNA。中华生物医学工程学报,2003,17(4):761-773。
rangtpase调节着丝点功能。开发单元5,99-111(2003)。
Ren, M.等。Ran GTPase的不同结构域与不同的因子相互作用,调节核蛋白的输入和RNA的加工。摩尔。细胞。生物学报,15,21(5):387 - 398。
Costanzo, M.等人。一个全球性的基因相互作用网络绘制了细胞功能的接线图。科学353,aaf1420(2016)。
盖耶,M.等。核gtp结合蛋白Ran及其与交换因子RCC1和效应蛋白RanBP1的复合物的构象状态。生物化学38,11250-11260(1999)。
Henriksen, P.等人。蛋白质组分析表明赖氨酸乙酰化在酿酒酵母中具有广泛的调控作用。摩尔。细胞。蛋白质组学11,1510-1522(2012)。
de Boor, S.等。小gtp结合蛋白Ran受翻译后赖氨酸乙酰化调控。自然科学进展。[j] .中国科学院学报(自然科学版),2011(5):379 - 388。
贝斯雷·乌纳尔,E.等。Ras - GTPase调控因子的系统水平表达相关性。细胞Commun。信号,16,46(2018)。
Görlich, D, Seewald, M. J. & Ribbeck, K.基于动力学测量和计算机模拟的ran驱动货物运输和RanGTPase系统表征。中国生物医学工程学报,2009,32(2):481 - 481。
综述系列:Rab gtp酶与膜同一性:因果关系或无关关系?[j] .中国生物医学工程学报,2016,32(2):481 - 481(2013)。
蛋白质结构区域的简单定义及其在分析界面演化中的应用。中国生物医学工程学报,2003,26(4):444 - 444(2010)。
Rojas, A. M., Fuentes, G., Rausell, A.和Valencia, A. Ras蛋白超家族:进化树和保守氨基酸的作用。中国生物医学工程学报,2016,33(2):481 - 481。
Collins, s.r, Roguev, A. & Krogan, n.j.使用E-MAP方法的定量基因相互作用定位。方法:中国生物医学工程学报,2010,33(4):559 - 561。
等人。通过上位微型阵列研究酵母早期分泌途径的功能和组织。Cell 123, 507-519(2005)。
Giaever, G.等。酿酒酵母基因组的功能分析。自然,418,387-391(2002)。
柯林斯,s.r.等。利用遗传相互作用图对酵母染色体生物学中涉及的蛋白质复合物进行功能解剖。自然,446,806-810(2007)。
Cherry, J. M.等。酵母菌基因组数据库。核酸学报,26,73-79(1998)。
控制错误发现率——一种实用而强大的多重测试方法。J. R.州社b57,289 - 300(1995)。
叶库蒂利,D.依赖关系下多重测试中错误发现率的控制。安。法典29,1165-1188,1124(2001)。
Jäger, S.等。hiv -人类蛋白复合物的全球景观。自然,481,365-370(2011)。
Jäger, S.等。hiv -人蛋白复合物的纯化和鉴定。方法53,13 - 19(2011)。
MaxQuant能够实现高肽鉴定率,个性化p.p.b范围质量准确性和蛋白质组范围的蛋白质定量。生物技术学报,26,1367-1372(2008)。
考克斯,J.等。通过延迟归一化和最大肽比提取,精确的蛋白质组全范围无标记定量,称为MaxLFQ。摩尔。细胞。蛋白质组学13,2513-2526(2014)。
Teo, G.等。SAINTexpress: INTeractome软件显著性分析的改进和附加功能。[j] .中国生物医学工程学报,2014,37-43。
Choi, M.等。MSstats:一个R软件包,用于基于定量质谱的蛋白质组学实验统计分析。生物信息学学报,2014,25(2):526 - 526。
高密度振荡培养中自动诱导蛋白的产生。蛋白表达纯化。41,207-234(2005)。
马克利,j.l.等人。蛋白质和核酸的核磁共振结构表示建议- iupac - iubmb - iupab核磁共振光谱测定的蛋白质和核酸结构数据库标准化国际联盟任务组j . Biomol。核磁共振12,1 - 23(1998)。
Mishra, A. K. & Lambright, D. G.分析Rab gtpase激活蛋白底物特异性的高通量分析。方法生物化学学报,129,47 - 60(2015)。
Goudar, C. T, Sonnad, J. R. & Duggleby, R. G.利用积分Michaelis-Menten方程的直接解进行参数估计。生物化学。生物物理学。学报1429,377-383(1999)。
Malaby, a.w.等。排除粒径色谱分析方法-小角度x射线散射和蛋白质散射重建。j:。晶体学报,48,1102-1113(2015)。
Klebe, C, Bischoff, F. R, Ponstingl, H. & Wittinghofer, A.核gtp结合蛋白Ran与其调控蛋白RCC1和RanGAP1的相互作用。生物化学34,639-647(1995)。
致谢
我们感谢R. Ordonez对突变设计的贡献;C. Melero, D. Jeon, S. Mathur, R. D. Kim和K. Kundert提供技术帮助;M. Jaime Garza对核磁共振构象分析的贡献;C. Ryan咨询E-MAP分析;D. Agard, G. Narlikar, J. Fraser和J. M. Thornton进行讨论。这项工作得到了美国国立卫生研究院(R01-GM117189)对T.K.和Henry Wellcome爵士博士后奖学金(101614/Z/13/Z)对T.P. C.J.P.M.的资助,他是UCSF发现研究员。T.K.是陈·扎克伯格生物中心的调查员。
作者信息
作者及单位
贡献
T.P、C.J.P.M、n.j.k和T.K.确定并发展了核心问题。T.P.和C.J.P.M.进行了大部分的实验和数据分析。J.X.和T.P.进行了E-MAP筛检。G.M.J.进行了下拉实验。D.L.S.和R.K.进行了质谱实验,并与T.P.一起分析了数据。N.O.参与了Gsp1突变体的设计。H.B.参与了E-MAP分析。M.J.S.K.建议进行核磁共振研究。C.J.P.M.和M.J.S.K.进行了核磁共振实验并分析了数据。T.P.进行了动力学实验。D.G.L.参与了动力学数据的分析。tp, C.J.P.M.和yz纯化了蛋白质。Y.Z.进行western blot实验。T.P, C.J.P.M.和T.K.在其他作者的协助下完成了这份手稿。n.j.k和T.K.监督了这个项目。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益冲突。
额外的信息
《自然》感谢Katrin Rittinger和其他匿名审稿人对这项工作的同行评议所做的贡献。
施普林格·自然对已出版地图的管辖权要求和机构关系保持中立。
扩展数据图和表
图1 .的界面点突变设计酿酒酵母Gsp1。
界面残留物分为界面核心、界面边缘和界面支撑位置(见补充方法),见补充表2。a-f, RAN (Gsp1)在伴侣结合构象中的结构,界面残基被伴侣蛋白着色。所有突变的Gsp1残基都显示为球体。a、Srm1 (GEF)接口芯(暗青色)和接口圈及支撑(浅青色)PDB 1I2M;b、Rna1 (GAP)接口核心(深橙色)和接口边缘及支撑(浅橙色)PDB 1K5D;c、Ntf2接口芯(深紫色)和接口圈及支架(浅紫色)PDB 1A2K;d, Yrb1和Yrb2界面核心(深黄色)和两个界面中仅一个(浅黄色)PDB 1K5D的残基;e、Srp1接口芯(深粉色)和接口边缘及支撑(浅粉色)PDB 1WA5;f,位于四个或更多(深绿色),两个到三个(绿色)和一个(浅绿色)核细胞蛋白界面核心的残基。核细胞蛋白有:Kap95、Crm1、Los1、Kap104、Msn5、Cse1、Mtr10。PDB 2 bku。g, Gsp1残基在伙伴界面中的位置。核苷酸5 Å内的残基、典型p环或开关I区或II区22均未发生突变。属于开关I、开关II和c端α螺旋的残基用深蓝色条表示。选择的Gsp1点突变替换如补充表3所示。
图2 . Gsp1内源性表达水平酿酒酵母具有基因组整合的菌株GSP1western blot分析点突变。
a,强突变体的表达数据,定义为具有9个或更多显著GIs的突变体。b,弱突变体的表达数据,定义为具有少于9个显著GIs的突变体。在a和b中,条高表示在不同天数生长的两个或多个生物重复(n)的平均值(T34D除外,它只有一个生物重复),误差条表示n >= 3时的一个标准差。覆盖的点表示单个生物重复(对于野生型和MAT:α菌株,每个生物重复平均至少有12个技术重复,对于突变菌株,每个生物重复平均有1到6个技术重复)。表达水平与野生型Gsp1蛋白克隆耐药标记(WT)的相对表达水平为红色虚线(相对表达量为1)。MAT:α为起始酿酒酵母菌株(见补充方法)。c,强弱突变体的平均相对表达量分布。每个点如图a和b所示。水平粉色条表示点分布的平均值。
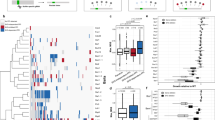
扩展数据图3 56例的GI剖面GSP1(野生型菌株GSP1使用克隆nat磁带和55点突变体)。
负s评分(蓝色)代表合成病态或合成致死性地理标志,正s评分(黄色)代表抑制性或上位性地理标志;中性s评分(无显著GI)用黑色表示。采用Pearson相关对Gsp1点突变体和酿酒葡萄球菌基因进行分层聚类。GSP1突变体分为两类:一类是23个强突变体,具有9个或更多的重要地理标志;另一类是32个弱突变体,具有少于9个重要地理标志。
扩展数据图4GSP1突变不能仅仅用突变在界面中的位置来解释。
a,结构表征界面中突变残基的位置。ΔrASA是结合时残基的可接近表面积的差异,相对于每种氨基酸残基类型的溶剂可接近表面积的经验最大值(见补充方法)。b, GSP1突变体通过生物过程和复合物(如dynein/dynactin通路、SWR1复合物、Hog1信号通路、mRNA剪接、线粒体蛋白和Rpd3L组蛋白去乙酰化酶复合物)对酵母基因进行GI谱分析。c, GSP1强突变体的GI谱与GSP1直接相互作用的等位基因之间的Pearson相关分布(左),以及所有其他酿酒葡萄球菌基因的GSP1强突变体与等位基因之间的Pearson相关分布(右)。d, Gsp1相互作用伙伴的GI谱与强弱Gsp1突变体之间的Pearson相关性分布,如果突变在与该伙伴的界面上是(黑色和浅紫色)或不是(灰色和深紫色)。右边的蓝色小提琴图表示GSP1突变体和酿酒葡萄球菌基因之间所有其他Pearson相关性的分布。在c和d中,点的大小表示错误发现率调整后的Pearson相关单侧(正)p值,粉色条表示点分布的平均值;n为每一类GSP1点突变基因GI谱相关性的个数。强突变体的数据也显示在图1e中,并在这里进行比较。
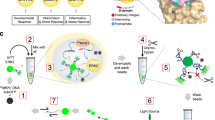
图5 Gsp1中接口点的突变重新连接了其物理相互作用网络。
a,亲和纯化质谱(AP-MS)实验示意图,以确定野生型和突变型Gsp1的下拉蛋白相互作用伙伴的丰度。在b、c和d中,Gsp1突变体下拉的伴侣蛋白丰度的变化表示为Gsp1突变体下拉的伴侣蛋白丰度与野生型Gsp1下拉的伴侣蛋白丰度之间的log2转化折叠变化(log2(abundance(PREY)MUT/abundance(PREY)WT)。为了解释可能的标签效应,猎物丰度的折叠变化总是相对于具有相应标签的野生型蛋白质进行计算。与野生型Gsp1相比,下拉型的丰度减少用红色标注,丰度增加用蓝色标注。log2变换后的折叠变化值上限为+/−4。b,氨基和c,羧基末端3xflag标记的Gsp1点突变体(行)和AP-MS鉴定的猎物蛋白(列)通过log2转化的猎物丰度折叠变化分层聚类。d, Prey蛋白被氨基和羧基末端标记结构拉低。左半圆表示氨基末端3xflag标记的Gsp1点突变体,右半圆表示羧基末端3xflag标记的Gsp1点突变体。与野生型Gsp1的复合物相比,Gsp1突变体的下拉复合物中猎物丰度的log2变换折叠变化(错误发现率调整的p值)的显著性与半圆大小成正比。总的来说,我们确定了316个高可信度的猎物伴侣蛋白,其中氨基和羧基末端标记的Gsp1突变体分别捕获了264个和103个猎物,其中包括51个重叠猎物。用N端或c端标签识别的猎物的差异说明了相互作用网络对Gsp1扰动的敏感性。
图6 Gsp1界面突变重新连接了与核心调控因子Srm1和Rna1的相互作用。
a, b,存在共复杂x射线晶体结构的Gsp1界面突变体(核心调节因子Srm1和Rna1,以及效应因子Yrb1、Kap95、Pse1和Srp1)与Gsp1伴侣之间的蛋白-蛋白相互作用。下拉猎物伴侣丰度的变化表示为log2(猎物丰度/猎物丰度wt))。N-3xFL和C-3xFL标记的突变体分别用氨基端或羧基端三重FLAG标记,伴侣体按指示着色。a,柱状图描述了当点突变位于与猎物的Gsp1界面的核心时,下拉猎物伴侣丰度的变化。b,条形图描述了核心调节因子Srm1和Rna1以及效应因子Yrb1、Kap95、Pse1和Srp1的下拉猎物伴侣丰度的所有变化,无论突变是否直接位于与伴侣的界面核心。c,所有猎物蛋白在Gsp1突变体下拉时的log2转化折叠丰度变化的分布,由突变体间的四分位数范围(IQR)定义。核心合作伙伴的值如箭头所示(Rna1橙色,Srm1青色,Yrb1黄色,Kap95绿色,Pse1浅绿色,Srp1粉红色)。IQR值的平均值和+1标准差分别用深灰色和浅灰色箭头突出。两种周期调节因子Rna1和Srm1的丰度在Gsp1点突变体中的变化程度大于平均猎物蛋白的变化程度。所有IQR值见补充表5。d、T34相对于Rna1 (GAP,橙色面,PDB 1K5D)、Srm1 (GEF,青色面,PDB 2I1M)、Yrb1(黄色面,PDB 1K5D)的接口位置。由于T34的坐标在2I1M结构中没有被解析,所以在这三个结构中,粉色的球体都显示了在对齐的1K5D结构中的残留位置。Gsp1:海军蓝卡通;GTP核苷酸:棒状表示。在Rna1和Srm1界面上突变的残基以球体表示,并以橙色(Rna1,左)或青色(Srm1,中)表示。
图7 Gsp1点突变对gap介导的GTP水解和gef介导的核苷酸交换体外效率的影响。
a, kcat和b, Gsp1与野生型和点突变体GTP水解的Km值。误差条表示n≥3个重复时综合Michaelis-Menten拟合的kcat和Km参数的标准差。c, kcat和d, Km的gef介导的野生型和点突变体Gsp1的核苷酸交换。下图显示了除了4个Km最高的突变体(K101R、R108L、R108I和R108Y)之外的所有突变体的Km条形图。误差条表示不同底物浓度下n≥17次测量数据的Michaelis-Menten拟合的正/负标准误差值。a, b, c, d,虚线表示野类型值。深蓝条表示野生型Gsp1,橙色和青色条分别表示与GAP和GEF交界面的核心残基。e, gap介导的GTP水解(橙色条)和gef介导的核苷酸交换(青色条)催化效率的相对变化比较,定义为kcatMUT/KmMUT / kcatWT/KmWT。灰线表示与野生型相比增加三倍,黑线表示与野生型相比减少三倍。误差条表示突变体和野生型效率(kcat/Km)值的平均值(GAP)或拟合值(GEF)的附加标准误差。与野生型Gsp1相比,非GAP界面核心突变增加了(3倍,R108G突变),降低了(3 ~ 10倍,T34E/Q/A/G, R78K, D79S/A, R108I和R112S突变)GTP水解催化效率kcat/Km。正如预期的那样,GEF界面核心的突变(K101和R108)使GEF介导的核苷酸交换的催化效率降低了40倍以上。然而,其他不在GEF界面核心的突变(R78K, R112S, Y157A)也显著降低了效率(3- 10倍)。
图8 Gsp1界面突变以变构的方式调节GTP水解速率。
a,加载GTP的野生型Gsp1的1D 31P核磁共振谱注释。峰面积计算的间隔显示,并归一化为GTPβ结合峰。从左到右的峰对应于:游离磷酸盐(Pi), GDP与Gsp1结合的β磷酸盐(GDPβ结合),游离(未结合)GDP的β磷酸盐(GDPβ游离),GTP与Gsp1结合的γ磷酸盐(γ1), GTP与Gsp1结合的γ磷酸盐(γ2),结合或未结合的GDP或GTP的α磷酸盐,GTP与Gsp1结合的β磷酸盐(GTPβ结合),游离(未结合)GTP的β磷酸盐(GTPβ游离)。b,野生型Gsp1和突变体的内在GTP水解率。虚线表示野类型值。误差条表示n≥3个重复的标准差(点)。c, γ - 2和γ - 1构象之间的自然对数变换交换平衡常数,与GTP内在水解的相对速率对应,以突变体水解速率与野生型水解速率之比的自然对数表示。粉红色的线是线性拟合。误差条表示n≥3个本征GTP水解测量重复的标准差。d, Y157, H141, Q147(粉色球体)在Crm1界面(灰色表面,PDB 3M1I)中的位置。Gsp1:海军蓝卡通;GTP核苷酸:黄色棒状表示。e, T34(粉色球体)与Yrb1(灰色表面,PDB 1K5D)界面的位置。GTP的γ磷酸到残基α-碳的距离表示在d和e的残基数下面。
图9猎物蛋白的相对丰度覆盖了每个突变对gap介导的GTP水解和gef介导的核苷酸交换相对体外效率的影响。
相对gap介导的水解和gef介导的交换效率用ln(kcatMUT/KmMUT/kcatWT/KmWT)表示。影响gef催化核苷酸交换效率(kcat/Km)大于gap催化GTP水解效率的突变体位于对角线上方,影响gap催化水解效率的突变体位于对角线下方。左半圆表示氨基末端3xflag标记的Gsp1点突变体,右半圆表示羧基末端3xflag标记的Gsp1点突变体,相对于带有相应标记的野生型Gsp1。a, color表示每个Gsp1点突变体与野生型相比的GAP和GEF丰度折叠变化的log2变换比率,定义为log2((abundance(Rna1)MUT/abundance(Rna1)WT)/(abundance(Srm1)MUT/abundance(Srm1)WT)))。橙色突变体下拉Rna1 (GAP)相对较少,而蓝绿色突变体下拉Srm1 (GEF)相对较少。b-f, color表示突变型和野生型下拉猎物蛋白的对数变换比,表示为log2(猎物丰度emut /猎物丰度wt)。对数变换的相对丰度值上限为+/ - 4。与野生型Gsp1复合物相比,带有突变体Gsp1的下拉复合物中AP-MS的猎物丰度减少,用红色表示,丰度增加用蓝色表示。猎物蛋白:b, Rna1 (GAP);c, Srm1 (GEF);d, Yrb1;e, Kap95, f, Vps71。Yrb1遵循与Rna1 (GAP)相似的模式,而Kap95和Vps71与Srm1 (GEF)相似。
扩展数据图10酿酒酵母按生物功能分组的基因。
假发现率的热图调整了22个强GSP1点突变体的GI谱与文献14中酿酒葡萄球菌基因敲除或敲除的GI谱之间Pearson相关性的单侧(正)p值。p值表示为白色到灰色的范围,如图4a所示。基因根据其生物学功能被组织成基因集(方法)。热图上方的线形图与图4c相同。a, GSP1点突变体和GSP1结合伴侣的等位基因,具有可用的共络合物x射线晶体结构,以及酿酒葡萄球菌参与RNA和蛋白质核运输的基因。b, GSP1点突变体和酿酒葡萄球菌参与转录调控或5 ' mRNA capping的基因。c、GSP1点突变体和酿酒酵母基因参与细胞质到液泡靶向(CVT)途径、肌动蛋白、微管蛋白和细胞极性。
补充信息
补充信息
本文件包含补充讨论、补充方法、补充图1-16、补充表1-9和补充参考文献。
补充数据1
来自E-MAP筛选的基因相互作用(GI)数据。该文件包含56个酿酒葡萄球菌菌株(野生型和55个GSP1点突变体)的遗传相互作用(GI)评分(S-scores)。
补充数据2
SGA基因与GSP1点突变体基因谱的两两Pearson相关性,P值相关。该文件包含GSP1点突变体的遗传相互作用谱与酿酒酵母等位基因的遗传相互作用谱之间的Pearson相关系数和随附的P值,这些基因相互作用谱来自文献14发表的CellMap SGA数据集。
补充数据3
亲和纯化质谱(AP-MS)数据报告为倍数变化和显著性值,以及显著相互作用命中列表。该文件包含两个表。表1包含Gsp1点突变体的亲和纯化质谱(AP-MS)数据。表中的数据是MSstats35(见补充方法)的输出,报告了下拉蛋白的丰度,与野生型相比,具有适当3×Flag标签的丰度的对数变换折叠变化,以及随附的fdr调整的P值。提供了可用的全局和均衡中位数归一化方法的数据。表2包含了我们AP-MS实验中Gsp1的高置信度相互作用伙伴列表(由SAINTexpress(参考文献34)确定,见补充方法)。
41586 _2021_3982_moesm6_esm.xlsx
补充数据4 SGA数据中与GSP1突变体显著正相关的酿酒葡萄球菌基因按生物学功能组织成基因集。该文件提供了来自SGA数据集的酿酒葡萄球菌等位基因列表,这些等位基因的GI谱与GSP1突变体的GI谱有显著相关性(见方法)。这些基因根据其生物学功能被人工分组为“基因集”(如Saccharomyces Genome Database, https://www.yeastgenome.org中的注释)。
权利和权限
关于本文
引用本文
佩里卡,T.,马西,C.J.P,徐,等。变构扰动对模型分子开关的系统级影响。《自然》(英文版),2009,42 - 44。https://doi.org/10.1038/s41586-021-03982-6
收稿日期:2020年1月1日
录用日期:2021年9月1日
发布日期:2021年10月13日
发行日期:2021年11月4日
DOI: https://doi.org/10.1038/s41586 - 021 - 03982 - 6
这篇文章是由
-
设计变构蛋白逻辑
细胞发现(2024)
-
KRAS抑制的能量和变构景观
自然(2024)
-
从系统到结构-使用遗传数据来模拟蛋白质结构
自然评论遗传学(2022)
评论
通过提交评论,您同意遵守我们的条款和社区准则。如果你发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。